Томмазо Кай a*, Андреа Коччи b, Франко Коккарелли a, Лоренцо Руджера c, Паоло Ланцафаме d, Патрицио Качалье e, Джанни Малоссини a, Альфонсо Крисци b Альберто Тринчиери f Джампаоло Перлетти g,h, Марко Карини b, Гернот Бонкат i, Риккардо Бартолетти j Трулс Э. Берклунд Йохансен k
Отделение урологии, больница Санта-Кьяра, Тренто, Италия; b Факультет урологии, Университет Флоренции, Флоренция, Италия; c Факультет урологии Падуанского университета, Падуя, Италия; d Факультет микробиологии, региональная больница Санта-Кьяра, Тренто, Италия; e Факультет лабораторной медицины, Региональная больница Санта-Кьяра, Тренто, Италия; f Отделение урологии, больница Манцони, Лекко, Италия; g Факультет биотехнологии и наук о жизни, Отделение медико-хирургических наук, Университет Инсубрии, Варезе, Италия; h Факультет медицины и медицинских наук, Гентский университет, Гент, Бельгия; i Факультет урологии, Alta Uro AG, Базель, Швейцария; Факультет урологии, Пизанский университет, Пиза, Италия; k Факультет урологии, Университетская клиника Осло, Осло, Норвегия
Ключевые определения:
Бактериурия
Ретроградная интраренальная хирургия
Устойчивость к антибиотикам
Инфекция мочевыводящих путей
Мочевые камни
Аннотация
Предпосылки к работе: Патогенез инфекционных осложнений после ретроградной интраренальной хирургии (РИРХ) до конца не изучен.
Цель: Оценить распространение бактерий в ирригационной жидкости и крови во время РИРХ при удалении камней и выявить взаимосвязь такого распространения с инфекционными осложнениями.
Проект, исходные данные, участники: В настоящее проспективное продолжительное групповое исследование включены 38 пациентов, которым провели РИРХ по поводу камней в двух урологических отделениях c января по декабрь 2017 года.
Введение: Перед операцией был произведен посев мочи и проведена антимикробная профилактика в соответствии с рекомендациями Европейской ассоциации урологов. Образцы крови и ирригационной жидкости собирали в начале эндоскопической процедуры и через каждые 30 минут в течение процедуры. Все образцы были подвержены микробиологическим исследованиям, а результаты были сопоставлены с клиническими данными.
Измерение результатов и статистический анализ: Симптоматические и бессимптомные инфекционные осложнения мочевыводящих путей были сопоставлены с микробиологическими и клиническими данными с использованием t-критерия Стьюдента или U-критерия Манна-Уитни.
Результаты и ограничения: Результаты исследования проб десяти пациентов показали значительный рост бактерий в образцах ирригационной жидкости (у семи – кишечная палочка, у двоих – клебсиелла пневмонии и у одного – синегнойная палочка). У восьми пациентов (21%) имело место лихорадка в связи с инфекцией мочевыводящих путей во время пребывания в стационаре: у двух наблюдался рост бактерий в ирригационной жидкости (25%), у одного была бактериемия (12,5%). Корреляции между ростом количества бактерий в образцах ирригационной жидкости и посевах мочи, которые были взяты до процедуры, или между ростом бактерий в образцах ирригационной жидкости и развитием послеоперационных инфекционных осложнений не обнаружено. Предшествующее использование фторхинолонов и наличие в анамнезе инфекций мочевыводящих путей были связаны с инфекционными осложнениями после РИРХ.
Заключение: Мы продемонстрировали распространение бактерий в ирригационную жидкость во время процедур РИРХ, но это распространение не было связано с развитием инфекционных осложнений. Перед назначением антимикробной профилактики особое внимание следует уделять предшествующему лечению антибиотиками.
Итоги по пациентам: Распространение бактерий в ирригационную жидкость – обычное явление во время ретроградной интраренальной хирургии, но оно не связано с развитием инфекционных осложнений после процедуры. Особое внимание следует уделять предшествующему лечению антибиотиками до назначения антимикробной профилактики.
1. Введение
За последние 10 лет ретроградная интраренальная хирургия (РИРХ) становиться все более распространенным методом лечения камней почек. [1,2]. Несмотря на хорошие показатели безопасности, были описаны и тяжелые осложнения, такие как уросепсис и даже смерть [3,4]. Инфекция мочевыводящих путей (ИМП) является самым распространенным осложнением после лечения, и, несмотря на адекватную периоперационную антимикробную профилактику (ПАП), сообщалось о риске послеоперационной лихорадки в 4,4% и сепсисе в 0,7% случаев. [5]. Самым вероятным патогенетическим механизмом инфекционных осложнений является то, что содержащиеся в камне бактерии попадают в мочу с последующей системной транссудацией, и это приводит к симптоматической ИМП или сепсису. В целях снижения риска симптоматических ИМП и уросепсиса после РИРХ, основные Рекомендации (Гайдлайны) Американской урологической ассоциации предлагают оперировать только пациентов со стерильной мочой, назначать профилактические антибиотики всем пациентам, выполнять ирригацию осторожно, проверяя при этом непрерывность вытекания, время операции не должно превышать 2 ч, и внимательно наблюдать за пациентами в первые 6 послеоперационных часов [7]. С ругой стороны, Рекомендации Европейской ассоциации урологов (EAU) предлагают использовать ПАП только у пациентов с высоким риском инфекционных осложнений. Потенциальные факторы риска: размер камня, его локализация, кровотечение и опыт хирурга [8]. Однако, несмотря на эти рекомендации, до сегодняшнего дня ни одно исследование не продемонстрировало распространение бактерий в ирригационную жидкость или кровь во время РИРХ.
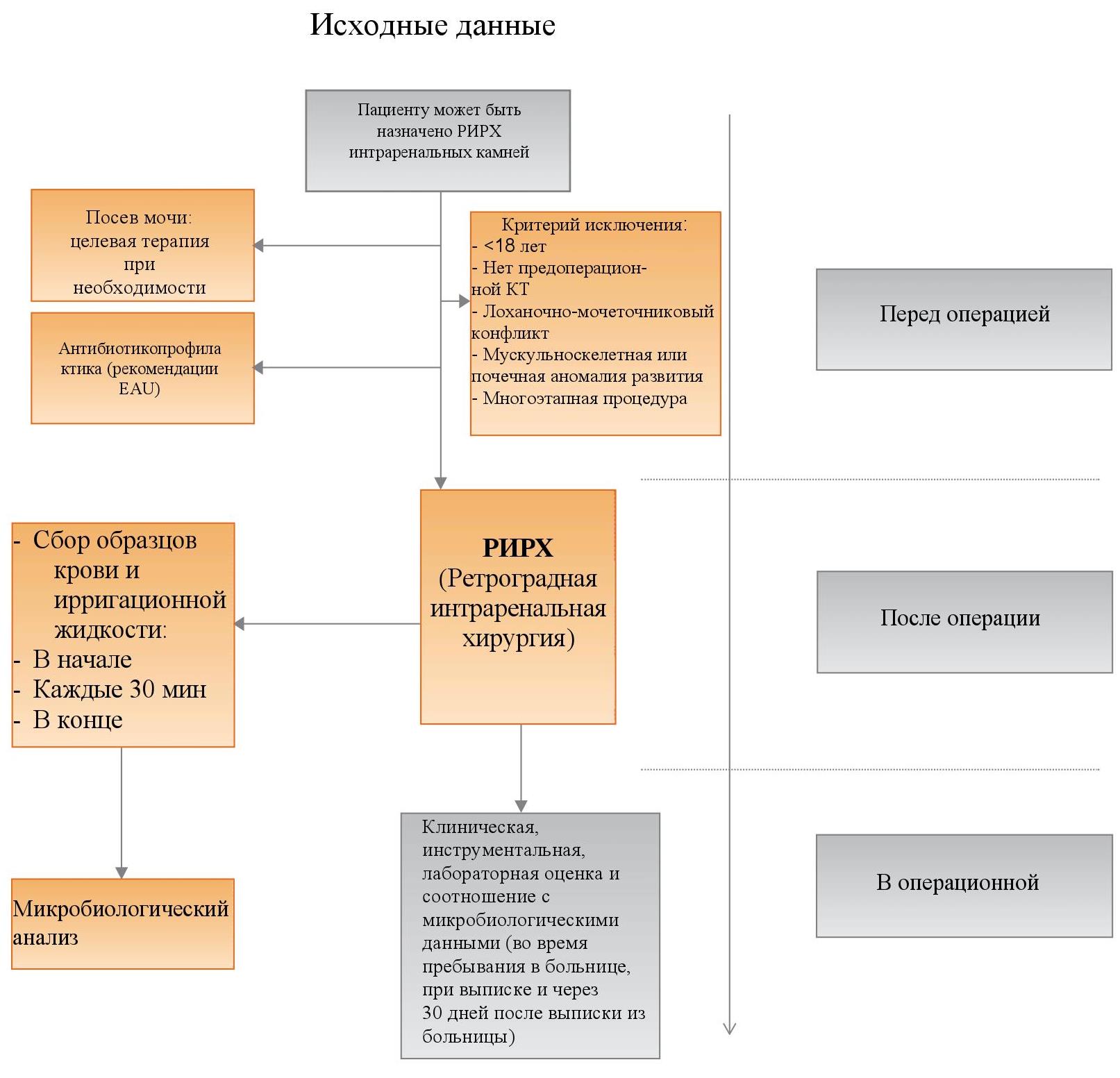
Рис. 1 – Этапы исследования в соответствии с рекомендациями STROBE. КТ = компьютерная томография; EAU = Европейская ассоциация урологов; РИРХ = ретроградная интраренальная хирургия.
Восполнение этого пробела улучшит обоснование для ПАП и поможет определить самый подходящий антибиотик и схему его назначения. Мы стремимся проанализировать распространение бактерий в ирригационную жидкость и кровь во время процедуры РИРХ интраренальных камней, и сопоставить результаты с клиническими параметрами и развитием инфекционных осложнений после процедуры.
2. Пациенты и методы
2.1 Испытуемая группа, проект и график
С января 2017 года по декабрь 2017 года для настоящего проспективного продолжительного группового исследования мы отобрали 38 пациентов в двух урологических отделениях. Все пациенты прошли РИРХ интраренальных камней. Посев мочи брался перед операцией, а ПАП проводили в соответствии с рекомендациями EAU [8]. В случае положительного посева мочи перед РИРХ проводилась целевая терапия, перед операцией анализировали новый образец мочи, чтобы продемонстрировать отрицательный посев. Образцы крови и ирригационной жидкости отбирались в начале эндоскопической процедуры и каждые 30 минут до окончания процедуры. Фиксировалось наличие симптоматических и бессимптомных инфекционных осложнений мочевыводящих путей, которое сопоставлялось с микробиологическими и клиническими данными. Рисунок 1 отображает регламент исследования. Первичной конечной точкой исследования послужила распространенность фебрильных или афебрильных инфекционных осложнений после РИРХ, а также корреляция между этими осложнениями и распространением бактерий в ирригационную жидкость и кровь, выявленном во время процедуры. Это исследование выполнено как проспективное продолжительное групповое исследование [9], в соответствии с утверждением STROBE.
2.2. Клинические и процедурные обсуждения
Все пациенты перенесли РИРХ в соответствии с рекомендациями EAU для мочекаменной болезни [10]. Все процедуры выполнены двумя высококвалифицированными и опытными эндоурологами (Ф.С. Тренто и А.С. Флоренсе). Предварительно была проведена оценка размеров камня, анатомии собирательной системы почки и характеристик камня с помощью компьютерной томографии (КТ). Размер камня рассчитывали путем измерения самых длинных диаметров. Все пациенты были уложены в литотомическое положение на спине. Перед РИРХ была выполнена диагностическая полужесткая уретерореноскопия (8 Fr.; Карл Шторц, Туттлинген, Германия). Эту процедуру также обычно использовали для дилатации мочеточника. После этого, 9,5 или 11,5-Fr мочеточниковый кожух (Cook Medical) устанавливался в нужное положение. Гибкий уретероскоп Flex-X2 7,5-Fr (Карл Шторц) вводили по просвету кожуха. Использовался изотонический солевой раствор под давлением (100 мм рт.Ст.) со стандартной ирригационной системой. Для обработки каждого из камней использовалось лазерное волокно 272 мм. Мощность гольмиевого лазера была установлена в 10 Вт. Фрагментированные камни удалялись последовательно. По завершению удаления камня мочеточник осматривался по всей длине, с целью выявления каких-либо его повреждений. Обычно после процедуры мочеточниковый стент не устанавливался; он использовался в случае образования отека слизистой оболочки, ее повреждения, или когда продолжительность процедуры составляла 2 ч. и более. Мочеточниковый стент обычно удаляли в течение 2–4 недель после операции. [11]. Более того, интраоперационные пиелограммы выполнялись не у всех пациентов, а только в отдельных случаях. Диагноз симптоматической ИМП после РИРХ основывался на следующих параметрах: опрос пациента и симптомы, о которых сообщалось пациентом, физикальное обследование, общий анализ мочи и посев мочи. [8]. Были учтены предшествующая антибиотикотерапия и наличие ИМП в анамнезе, а так же использование антибиотиков для ведения ИМП на протяжении последних 6 месяцев[12], и один или несколько эпизодов ИМП в течение последнего года[13]. Мы исключили всех пациентов моложе 18 лет; а также пациентов без предоперационных данных КТ, с проблемами лоханочно-мочеточникового сегмента, а также с нарушением опорно-двигательного аппарата или почечной аномалией; пациентов с многоэтапными вмешательствами. РИРХ считалась успешной у пациентов, которые были полностью избавлены от камней или имели клинически незначимые фрагмены (<3мм) при послеоперационном обследовании.
2.3 Микробиологические и лабораторные исследования
Используемые микробиологические и лабораторные анализы были описаны нами в предыдущих сообщениях. [14,15]. Все образцы мочи для бактериологического анализа были собраны незадолго до процедуры и непосредственно перед ПАП. Во время проведения РИРХ, в операционной, в начале эндоскопической процедуры и каждые 30 минут вплоть до окончания вмешательства, анестезистом отбирался образец венозной крови из руки пациента. Образец ирригационной жидкости объемом 10 см3 отбирался через рабочий/ирригационный канал из почечной лоханки непосредственно перед фрагментацией камня. Методы сбора и объем образцов были оговорены с микробиологами до начала исследования. Образец ирригационной жидкости собирали каждые 30 мин вплоть до конца процедуры. Все образцы мочи и крови были немедленно доставлены в лабораторию в условиях охлаждения. Микробиологические исследования проводили согласно Хутон и др. [16]. При обнаружении бактерий в ходе микробиологической диагностики пороговым считалось количество колоний равное или большее 105 единиц/мл.
Таблица 1- Клинические, инструментальные и лабораторные характеристики пациентов.

2.4 Статистический анализ и этические соображения
Непрерывные переменные даны как среднее значение (стандартные отклонения), они сравнивались с использованием t-критерия Стьюдента или U-критерия Манна-Уитни. В соответствии с дизайном исследования, расчет размера выборки не потребовался. Все зарегистрированные значения p были двусторонними. Статистический анализ выполнен с использованием программного обеспечения IBM SPSS 20.0 для Apple-Macintosh (IBM, Нью-Йорк, США). Отдельного согласия не требовалось, поскольку все выполнялось в рамках стандартных процедур. Все пациенты подписали согласие на выполнение хирургической процедуры, и были проинформированы о характере исследования и взятии проб крови и ирригационной жидкости во время процедуры. Им сообщили, что сбор образцов не продлит время работы и не повлияет на результат РИРХ. Наше исследование проводилось в соответствии с Рекомендациями Good Clinical Practice и этическими принципами, изложенными в последней версии Хельсинской Декларации. Все анамнестические, клинические и лабораторные данные, содержащие конфиденциальную информацию о пациентах, были деидентифицированы с целью обеспечения анализа исключительно анонимных данных. Процесс деидентификации выполнялся немедицинским персоналом с помощью специального программного обеспечения.
3. Результаты
Все анамнестические, лабораторные, инструментальные и микробиологические характеристики анализируемых пациентов представлены в Таблице1. У трех пациентов отмечался гидронефроз I степени. Показатель удаления камней после РИРХ показан в Таблице1. У шести из 38 пациентов были положительные посевы мочи до РИРХ и их лечение выполнялось в соответствии с данными антибиограммы. Все микробиологические данные и графики лечения также описаны в Таблице1.
3.1 Микробиологические данные и связь с инфекционными осложнениями
Было отобрано 96 проб ирригационной жидкости и 93 образца крови. На каждого пациента собрано около 3,5 образцов. У трех пациентов последний образец крови не был взят из-за анестезиологических проблем. Среди всех пациентов, у 10 был определен значительный рост бактерий в образцах ирригационной жидкости. У всех пациентов этой группы отмечен значительный рост бактерий в одном или нескольких образцах ирригационной жидкости (диапазон 1-3). Кроме того, результаты одного пациента показали рост бактерий в крови во время вмешательства. У восьми пациентов (21%) развились ИМП с лихорадкой во время пребывания в стационаре. Среди пациентов с инфекционными осложнениями у двоих наблюдался рост бактерий в ирригационной жидкости (25%), а у одного – бактериемия (12,5%). И напротив, среди всех пациентов без осложнений восемь из 30 показали рост бактерий в ирригационной жидкости (26,6%). Комбинации штаммов не было. Все микробиологические данные представлены в Таблицах 2 и 3. Двадцать один пациент (55,2%) показал бессимптомную бактериурию (БСБУ) во время пребывания в стационаре. В соответствии с Рекомендациями EAU по урологическим инфекциям ни один пациент не получал лечение такой БСБУ. Кроме того, у восьми пациентов (21%) была отмечена ИМП с лихорадкой после процедуры, что потребовало лечения антибиотиками. Шести пациентам потребовался более длительный период госпитализации и парентеральное лечение антибиотиками широкого спектра действия. О серьезных осложнениях не сообщалось. Наиболее распространенным возбудителем болезни была устойчивая к фторхинолонам кишечная палочка. Среди всех пациентов без инфекционных осложнений после РИРХ, четверо сообщили о предществующем применении фторхинолонов и ИМП в анамнезе (13,3%).
ESBL = отрицательный штамм β -лактамазы с расширенным спектром.
3.2 Субанализ всех пациентов с симптомами ИМП
Восемь из 38 пациентов (21%) сообщили о симптомах ИМП после вмешательства. В этой группе у одного пациента было обнаружено распространение бактерий в кровь (Pseudomonas aeruginosa – штамм, устойчивый к β-лактамазе и фторхинолонам с расширенным спектром). Все эти пациенты получали ПАП фторхинолонами, а в одном случае – комбинацию фторхинолона и аминогликозида. Клинически значимых сопутствующих заболеваний зарегистрировано не было. В трех случаях сообщалось о ранее перенесенной ИМП и предшествующем применении антибиотиков (фторхинолонов) (37,5%). Ни у одного из пациентов не было обнаружено роста бактерий в моче перед РИРХ. Не было отмечено существенных различий в отношении локализации/размера камней, ранее перенесенной операции или установки DJ-стента между этой группой и другими пациентами, которые не сообщали о каких-либо симптомах ИМП после процедуры (Таблица 4). Никакой существенной связи между объемом ирригации, продолжительностью процедуры и инфекционными осложнениями после РИРХ не было зафиксировано.
Таблица 2 – Микробиологические данные во время процедур и результаты последующих исследований


Среди всех пациентов, которые сообщили об инфекционных осложнениях, у двух был бактериальный рост (25%), а у восьми из 30 пациентов без осложнений (26,6%) так же был бактериальный рост. Не было обнаружено корреляции между ростом бактерий в образцах ирригационной жидкости и послеоперационными симптоматическими или бессимптомными инфекционными осложнениями (р = 1,0). Также, не было обнаружено корреляции между ростом бактерий в образцах ирригационной жидкости и посевах мочи, взятых до процедуры.
Таблица 3 – Восприимчивость всех выделенных штаммов

Обсуждение
4.1 Основные результаты
Во время процедур РИРХ обычно встречается проникновение бактерий в ирригационную жидкость, но не бактериемия. Однако, мы не обнаружили никакой корреляции между проникновением бактерий в ирригационной жидкости и инфекционными осложнениями после РИРХ. Кроме того, пациенты, принимавшие фторхинолоны ранее, по-видимому, имеют высокий риск развития инфекционных осложнений после РИРХ.
4.2 Сравнение результатов с предшествующими исследованиями
Левофлоксацин SТщательное ведение пациентов с пиурией или наличием в анамнезе ИМП верхнего отдела необходимо для того, чтобы снизить риск послеоперационных фебрильных ИМП или уросепсиса[17]. Несколько авторов показали, что пиурия является важным фактором риска развития инфекционных осложнений после процедуры, а ПАП способна снизить этот риск [18].
Таблица 4 Сравнение пациентов с ИМП и без ИМП после РИРХ

Недавние систематический обзор и метаанализ показали, что однократная доза профилактических антибиотиков полезна для снижения частоты послеоперационной пиурии и бактериурии, хотя статистически значимых преимуществ в уменьшении послеоперационной ИМП зафиксировано не было. [19]. Эффективность ПАП в снижении риска инфекционных осложнений теоретически обусловлена влиянием антибиотика на распространение бактерий в почках во время литотрипсии. По этим причинам, в международных рекомендациях предлагается использовать антибиотики с высокой концентрацией в моче, чтобы контролировать распространение бактерий. Эта рекомендация не основана на точных знаниях патогенеза послеоперационных инфекционных осложнений после РИРХ, но основана на клинических исследованиях [7,8,20]. Даже если рекомендации по ПАП основаны на данных клинических испытаний, настоящее исследование дает важную новую информацию для более широкого понимания патофизиологии инфекционных осложнений после современной литотрипсии.
Ранее предполагалось распространение бактерий в ирригационную жидкость во время хирургической процедуры, но задокументировано это не было. Наш вывод состоит в том, что нет корреляции между распространением бактерий в ирригационной жидкости и развитием симптоматических инфекционных осложнений после процедуры, что расширяет наше понимание патогенеза инфекционных осложнений после РИРХ. Токас и др. [21] подчеркнули роль объема объема и скорости ирригации в качестве независимых факторов риска ИМП после RIRS [22]. Кроме того, увеличение объема инфузии коррелирует с увеличением внутрипочечного давления и последующим повышенным риском инфекционных осложнений. Здесь мы не обнаружили существенной корреляции между объемом ирригации и инфекционными осложнениями. Вероятно, это связано с тем, что для поддержания низкого уровня внутрипочечного давления, при всех процедурах мы использовали мочеточниковый кожух, как рекомендовано [23]. Однако, это только гипотеза, потому что мы не измеряли внутрипочечное давление. Согласно Токасу и др. [21], измерение внутрипочечного давления не является стандартной процедурой, а воспроизводимость и точность являются низкими. Тем не менее, мы полностью согласны с тем, что повышенное внутрипочечное давление остается забываемым предрасполагающим фактором развития осложнений эндоурологической хирургии верхних мочевыводящих и следует рассмотреть возможность интраоперационного контроля. Напротив, отсутствие корреляции между предоперационными результатами посева мочи, распространением бактерий и развитием инфекционных осложнений требует переосмысления принципов ПАП. Целью ПАП должно быть снижение бактериальной нагрузки в хирургическом поле, чтобы снизить риск инфекционных осложнений. В процедуре РИРХ операционным полем являются мочевыводящие пути, но инфекционные осложнения являются результатом распространения бактерий в кровь с последующей системной инфекцией. Следовательно, идеальный антибиотик, который следует использовать для предотвращения инфекционных осложнений после РИРХ, должен достигать более высокой концентрации в крови, чем минимальная ингибирующая концентрация для любого из возбудителей. В нашем исследовании у восьми пациентов развилась симптоматическая ИМП после РИРХ (21%). Анализируя эту группу пациентов, мы обнаружили, что только в одном случае выявлено проникновение бактерий в кровь. В этом случае имело место применение фторхинолонов и ИМП в анамнезе. Кроме того, у двух других пациентов с инфекционными осложнениями после РИРХ также сообщалось о предшествующем лечении ИМП фторхинолонами. Точная оценка характеристик пациента и анамнестических данных важна до принятия решения о РИРХ. Другим важным моментом является уровень локальной устойчивости бактерий. Сегодня устойчивость микроорганизмов практически ко всем классам антибиотиков резко возрастает [24]. Таким образом, следует избегать назначения ПАП препаратами, содержащими фторхинолоны, и их следует использовать только в исключительных случаях у пациентов, которые не получали фторхинолоновые препараты в течение последних 6 месяцев и которые не живут в районах с высокой распространенностью штаммов, устойчивых к фторхинолонам [12].
Сильные и слабые стороны настоящего исследования
Важным моментом, который следует подчеркнуть, является перспективный характер этого исследования, позволяет уменьшить погрешность, связанную со сбором данных. Более того, каждый опытный хирург в каждом центре также должен оценить сильную сторону этого исследования. В тоже время, ограниченное количество зарегистрированных пациентов может рассматриваться как ограничение, но следует принимать во внимание сложность забора и самого анализа проб. Кроме того, отсутствие посева самого камня является ограничением настоящего исследования. Несколько авторов сообщали о ценности получения мочи для посева непосредственно из почечной лоханки, чтобы обеспечить быстрое и адекватное лечение антибиотиками у пациентов, которые перенесли послеоперационные осложнения. [25,26]. Однако в наших центрах мы обычно не выполняем посев камня. Отсутствие измерения внутрипочечного давления также следует рассматривать как ограничение настоящего исследования.
Выводы
Это исследование показало распространение бактерий во время РИРХ в ирригационную жидкость, но не в кровь. Кроме того, распространение бактерий в ирригационную жидкость не связано с инфекционными осложнениями после РИРХ. Требуются дополнительные исследования, чтобы подтвердить эти результаты, а наши результаты требуют переосмысления принципов использования ПАП перед РИРХ.
[1] Giusti G, Proietti S, Peschechera R, et al. Sky is no limit for ureteroscopy: extending the indications and special circumstances. World J Urol 2015;33:257–73.
[2] Cindolo L, Castellan P, Scoffone CM, et al. Mortality and flexible ureteroscopy: analysis of six cases. World J Urol 2016;34:305–10.
[3] Fall B, Mouracade P, Bergerat S, Saussine C. Flexible ureteroscopy and laser lithotripsy for kidney and ureter stone: indications, morbidity and outcome. Prog Urol 2014;24:771–6.
[4] Watson JM, Chang C, Pattaras JG, Ogan K. Same session bilateral ureteroscopy is safe and efficacious. J Urol 2011;185:170–4.
[5] Berardinelli F, De Francesco P, Marchioni M, et al. Infective complications after retrograde intrarenal surgery: a new standardized classification system. Int Urol Nephrol 2016;48:1757–62.
[6] Wollin DA, Joyce AD, Gupta M, et al. Antibiotic use and the prevention and management of infectious complications in stone disease.
World J Urol 2017;35:1369–79.
[7] Wolf JS, Bennett CJ, Dmochowski RR, et al. Best practice policy statement on urologic surgery antimicrobial prophylaxis. https://
http://www.auanet.org/common/p...
Antimicrobial-Prophylaxis.pdf2014.
[8] EAU. European Association of Urology guidelines on urological infections, update 2018. http://uroweb.org/guideline/
urological-infections/.
[9] Porta M, editor. A dictionary of epidemiology. ed. 5. New York, NY:
Oxford University Press; 2008.
[10] EAU. European Association of Urology guidelines on urolithiasis, update 2018. http://uroweb.org/guideline/urolithiasis/.
[11] Demirbas A, Yazar VM, Ersoy E, et al. Comparison of percutaneous nephrolithotomy and retrograde intrarenal surgery for the treatment of multicalyceal and multiple renal stones. Urol J
2018;15:318–22.
[12] Sundvall PD, Elm M, Gunnarsson R, et al. Antimicrobial resistance in urinary pathogens among Swedish nursing home residents remains low: a cross-sectional study comparing antimicrobial resistance from 2003 to 2012. BMC Geriatr 2014;14:30.
[13] Parker AS, Cerhan JR, Lynch CF, Leibovich BC, Cantor KP. History of urinary tract infection and risk of renal cell carcinoma. Am J Epidemiol 2004;159:42–8.
[14] Cai T, Mazzoli S, Mondaini N, et al. The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: to treat or not to treat? Clin Infect Dis 2012;55:771–7.
[15] Cai T, Lanzafame P, Caciagli P, et al. Role of increasing leukocyturia for detecting the transition from asymptomatic bacteriuria to symptomatic infection in women with recurrent urinary tract infections: a new tool for improving antibiotic stewardship. Int J Urol 2018;25:800–6.
[16] Hooton TM, Scholes D, Gupta K, Stapleton AE, Roberts PL, Stamm WE. Amoxicillin-clavulanate vs ciprofloxacin for the treatment of uncomplicated cystitis in women: a randomized trial. JAMA 2005;293:949–55.
[17] Mitsuzuka K, Nakano O, Takahashi N, Satoh M. Identification of factors associated with postoperative febrile urinary tract infection after ureteroscopy for urinary stones. Urolithiasis 2016;44:257–62.
[18] Hsieh CH, Yang SS, Lin CD, Chang SJ. Are prophylactic antibiotics necessary in patients with preoperative sterile urine undergoing ureterorenoscopic lithotripsy? BJU Int 2014;113:275–80.
[19] Lo CW, Yang SS, Hsieh CH, Chang SJ. Effectiveness of prophylactic antibiotics against post-ureteroscopic lithotripsy infections: systematic reviewandmeta-analysis. Surg Infect(Larchmt)2015;16:415–20.
[20] Matsumoto T, Kiyota H, Matsukawa M, et al. Japanese guidelines for prevention of perioperative infections in urological field. Int J Urol 2007;14:890–909. EUF-687; No. of Pages 8
Please cite this article in press as: Cai T, et al. Infectious Complications After Laser Vaporization of Urinary Stones During
Retrograde Intrarenal Surgery Are Not Associated with Spreading of Bacteria into Irrigation Fluid but with Previous Use of
Fluoroquinolones. Eur Urol Focus (2019),
[21] Tokas T, Herrmann TRW, Skolarikos A, Nagele U, Training and
Research in Urological Surgery and Technology (T.R.U.S.T.) Group.
Pressure matters: intrarenal pressures during normal and pathological conditions, and impact of increased values to renal physiology. World J Urol 2019;37:125–31.
[22] Zhong W, Leto G, Wang L, Zeng G. Systemic inflammatory responseтsyndrome after flexible ureteroscopic lithotripsy: a study of risk factors. J Endourol 2005;29:25–8.
[23] Breda A, Territo A, López-Martínez JM. Benefits and risks of ureteral access sheaths for retrograde renal access. Curr Opin Urol 2016;26:70–5.
[24] Perletti G, Magri V, Cai T, Stamatiou K, Trinchieri A, Montanari E.
Resistance of uropathogens to antibacterial agents: emerging threats, trends and treatments. Arch Ital Urol Androl 2018;90:85–96.
[25] Walton-Diaz A, Vinay JI, Barahona J, et al. Concordance of renal stone culture: PMUC, RPUC, RSC and post-PCNL sepsis-a non-randomized prospective observation cohort study.IntUrolNephrol2017;49:31–5.
[26] Korets R, Graversen JA, Kates M, Mues AC, Gupta M. Post-percutaneous nephrolithotomy systemic inflammatory response: a prospective analysis of preoperative urine, renal pelvic urine and stone cultures. J Urol 2011;186:1899–903
