Juening Kanga,1, Yan Suna,1, Yaoliang Denga,b,*, Quan Liua, Derong Lia, Yunlong Liua, Xiaofeng Guana, Zhiwei Taoa, Xiang Wanga,*
a Отделение урологии, Первая больница при медицинском университете Гуанси, Наньнин, Китай
b Отделение урологии, больница Langdong медицинского университета Гуанси, Наньнин, Китай
⁎ Авторы-корреспонденты: Отделение урологии, Первая больница при медицинском университете Гуанси, Наньнин, Гуанси-Чжуанский автономный район, 530021, Китай.
E-mail адрес: dylkf317@163.com (Y. Deng), wang_xiang120@163.com (X. Wang).
1 Juening Kang и Yan Sun внесли одинаковый вклад в эту работу и поэтому имеют первое авторство.
Получена 22 июля 2019, получена после рецензии 5 ноября 2019, принята к публикации 5 ноября 2019
Ключевые слова:
Аутофагия
Стресс эндоплазматического ретикулума
Кальциево-оксалатный камень
Супероксиддисмутаза (СОД)
Аторвастатин (АТО)
Диэтилдитиокарбаминовая кислота (ДЭТК)
РЕЗЮМЕ
Предпосылки: нефролитиаз является распространенным заболеванием в урологии, и его патогенез связан с различными факторами. Недавние исследования показали, что активные формы кислорода (АФК) могут способствовать разрушению клеток (аутофагии) при образовании камней в почках и усугубить повреждение почек. Стресс эндоплазматического ретикулума (СЭР), ключевой фактор регуляции внутриклеточного гомеостаза, также напрямую связано с продукцией АФК. Таким образом, данное исследование направлено на изучение регулятивного влияния супероксиддисмутазы (СОД) на аутофагический СЭР ответ при образовании оксалата кальция (CaOx) в почечных камнях у крыс.
Методы. Тридцать две крысы были случайным образом разделены на четыре группы (n = 8):нормальная контрольная группа, группа животных с нефролитиазом, группа животных с нефролитиазом, которые получали аторвастатин, и группа животных с нефролитиазом, которые получали диэтилдитиокарбаминовую кислоту (ДЭТК). Образование почечных камней из CaOx моделировали путем внутрижелудочного введения 0,75% этиленгликоля в течение 4 недель. Соотношение массы почки к массе тела использовали для оценки увеличения массы почек. Функцию почек оценивали путем измерения уровня СОД в сыворотке, креатинина (КРЕ) и уровня азота мочевины в крови (АМК). Экспрессия связанных с аутофагией белков LC3B и BECN1 оценивалась с помощью иммуногистохимического окрашивания. Между тем, экспрессия белков, связанных с реакцией на аутофагию-СЭР, LC3B, BECN1, p62, GRP78 и CHOP оценивалась с помощью вестерн-блоттинга и ОТ-ПЦР. Оценка повреждения почечных канальцев СЭР липокалином, ассоциированным с нейтрофильной желатиназой (NGAL), и молекулы повреждения почки 1 (Kim -1) определяли с помощью иммуноферментного анализа. Апоптоз клеток почечных канальцев и экспрессия их сигнатурных белков, расщепленных каспазой-3, Bax и Bcl-2, были обнаружены с использованием метода ник-концевого мечения dUTP при помощи терминальной деоксинуклеотидил трансферазы и вестерн-блоттинга, соответственно. Осаждение кристаллов и повреждение гистологических тканей оценивали при окрашиванию по Von Kossa.
Результаты: по сравнению с контрольной группой, у группы животных с камнями наблюдался более высокий индекс соотношения массы почек к массе тела; очевидно более высокая экспрессия белков, связанных с реакцией аутофагии-СЭР и связанных с апоптозом белков LC3B, BECN1, GRP78, CHOP, Bax и расщепленной каспазы-3; и более низкие уровни белка р62, белка bcl-2 и СОД. В группе животных с нефролитиазом также наблюдались более высокие уровни апоптоза, CRE в сыворотке крови, АМК, NGAL и Kim-1, а также значительно большее отложение кристаллов и повреждение почек, чем в контрольной группе. Аторвастатин снижал уровни реакции аутофагии-СЭР, повреждения почек и отложения кристаллов, но они были повышены при введении ДЭТК.
Заключение. Повышенная активность СОД может защитить почки за счет снижения аутофагического ответа СЭР и образования CaOx почечных камней. Аторвастатин может быть новым вариантом профилактики и лечения нефролитиаза.
1. Введение
Нефролитиаз является распространенным многофакторным заболеванием в урологии, и его распространенность и частота сильно увеличились за последние несколько десятилетий. Это обусловлено взаимодействием генетических, экологических и метаболических факторов [1]. Основным компонентом камней является оксалат кальция (CaOx), который образуется в результате формирования ядер кристализации, перенасыщения, роста кристаллов и агломерации [2]. Наши последние исследования показывают, что аутофагия играет важную роль в образовании камней и что ингибирование аутофагии может уменьшить камнеобразование [3]. Тем не менее, его конкретный механизм действия остается неясным до настоящего времени.
Аутофагия - это процесс, при котором клетки организма используют лизосомы для разрушения своих же поврежденных органелл и макромолекул в отсутствие дефицита питательных веществ и окислительного воздействия, тем самым поддерживая стабильность внутриклеточной среды [4]. При стимуляции CaOx активные формы кислорода (АФК), возникающие в результате окислительного стресса, не могут разрушаться внутриклеточными антиоксидантами, которые могут, следовательно, вызывать аутофагию и травмировать эпителиальные клетки почечных канальцев [5–7]. При повышении уровня аутофагии в эпителиальных клетках почечных канальцев эндоплазматический ретикулум клеток подвергается ряду стрессовых реакций, таких как отек и деформация. Мы предполагаем, что если аутофагия регулирует образование кристаллов оксалата кальция в почках, она также регулирует стресс эндоплазматического ретикулума (СЭР). Многие ученые показали, что СЭР является ключевым фактором в инициации развернутого белкового ответа для восстановления внутриклеточного гомеостаза и что он напрямую связан с продукцией АФК [8,9].
В качестве антиоксидантного фермента супероксиддисмутаза (СОД) играет важную роль в удалении АФК, сопротивляясь окислительному стрессу и разлагая супероксид на кислород (O2) и пероксид водорода (H2O2) [10,11]. Аторвастатин (АТО) может уменьшить образование камней, усиливая активность СОД [12,13]. Однако регуляция аутофагии и СЭР с помощью СОД при образовании CaOx-содержащих почечных камней остается неясной. В этом исследовании ингибиторы АТО и СОД диэтилдитиокарбаминовой кислоты (ДЭТК) использовались для изучения того, регулирует ли СОД аутофагию-СЭР-ответ во время образования CaOx камней в почках, и для изучения механизма АТО в образовании CaOx камней в почках.
2. Материалы и методы
2.1. МАТЕРИАЛЫ И РЕАГЕНТЫ
Этиленгликоль (ЭГ) был приобретен в компании Sigma-Aldrich. ATO, буфер для лизиса радиоиммунопреципитации (РИП), фенилметилсульфонилфторид (ФМСФ) и 4', 6-диамидино-2-фенилиндол были приобретены в компании Solarbio (Пекин, Китай). ДЭТК был приобретен в компании Aladdin (Шанхай, Китай). Антитела против LC3B (2775), P62 (D5E2), CHOP (2895), Bax (2772), Bcl-2 (3869), расщепленной каспазы-3 (9661) и бета-актина (13E5) были приобретены у Cell Signaling Technology (Бостон, США). Антитела против Beclin1 (D160120) и GRP78 (D160466) были приобретены у Sangon Biotech (Шанхай, Китай). Антитела, конъюгированные с HRP мыши и кролика, были получены от Zhong shan Golden Bridge.
2.2. СОЗДАНИЕ ЖИВОТНОЙ МОДЕЛИ И ЛЕЧЕНИЕ
Все эксперименты на животных были одобрены Институциональным комитетом по уходу и использованию животных медицинского университета Гуанси. Всего в экспериментах использовали 32 взрослых самца крыс линии Sprague-Dawley (SD) весом 180-220 г. Модель оксалатного нефролитиаза у крыс была создана путем введения 0,75% ЭГ в питьевой воде в течение 4 недель [3]. Крыс случайным образом разделили на четыре группы (8 на группу): группа нормального контроля (НК), группа крыс, у которых был смоделирован нефролитиаз (ЭГ), группа с нефролитиазом, которая получала аторвастатин (ATO) и группа с нефролитиазом, которая получала диэтилдитиокарбаминовую кислоту (ДЭТК). Крысам в группе АТО внутрибрюшинно вводили АТО (2 мг/кг/день) каждый день, а крысам в группе ДЭТК внутрижелудочно вводили ДЭТК (350 мг/кг) каждый день днем [12–15].
2.3. Определение креатинина (КРЕ), азота мочевины и СОД в сыворотке крови
В конце эксперимента крыс анестезировали эфиром и отбирали образцы крови из полой вены. Уровни креатинина сыворотки (КРЕ), азота мочевины в крови (АМК) и СОД определяли с помощью полностью автоматизированного клинического химического анализатора (Hitachi 7600, Токио, Япония).
2.4. Иммуноферментный анализ (ИФА)
Через 4 недели лечения в метаболических клетках собирали образцы суточной мочи у животных. Уровни липокалина, связанного с нейтрофильной желатиназой (NGAL) и молекулы повреждения почек 1 (Kim-1), измеряли с использованием набора ИФА (Cusabio Biotech, Ухань, Китай) в соответствии с инструкциями производителя [3,12].
2.5. ГИСТОЛОГИЧЕСКОЕ И ИММУНОГИСТОХИМИЧЕСКОЕ ОКРАШИВАНИЕ
В конце эксперимента крыс умерщвляли, левые почки фиксировали 4% параформальдегидом и помещали в парафин. Срезы ткани (5 мкм) оценивали на осаждение кристаллов и повреждение тканей с использованием окрашивания по Von Kossa (Solarbio, Пекин, Китай) в соответствии с инструкциями набора. Иммуногистохимическое окрашивание секций (3 мкм) проводили путем регидратации, депарафинизации, восстановления под высоким давлением антигена с 0,01 моль/л цитрата натрия, 3% перекиси водорода для удаления эндогенной перекиси, 5% бычьего сывороточного альбумина; первичные антитела инкубировали в течение ночи при 4° C. После согревания при 37 ° С вторичные антитела инкубировали в течение 30 мин при комнатной температуре, окрашивали 3,3-диаминоанилином, контрастировали гематоксилином в течение 1 мин, дифференцировали спиртом, соляной кислотой, промывали PBS и затем герметизировали нейтральной смолой. Образцы оценивали под микроскопом (Olympus C-5050, Япония). Правую почку оставляли для морфологической оценки.
2.6. Вестерн-блот
Белок экстрагировали из ткани почки РИП лизатом с добавлением 1 мМ ФМСФ, а концентрацию белка определяли методом с использованием бицинхониновой кислоты. Образец белка загружали в равных количествах (50 мкг), разделяли путем электрофореза 12% SDS-PAGE и затем переносили на активированную метанолом ПВДФ-мембрану. Мембрану инкубировали с 5% обезжиренным молоком при 4° С в течение 1 часа, добавляли первичные антитела (1: 1000) и затем инкубировали при 4° С в течение ночи. После промывки TBST вторичные антитела (1: 2000) добавляли в течение 1 часа при комнатной температуре. Мембрану промывали TBST и затем сканировали. Был проведен анализ значения серого, отношение к внутреннему эталонному β-актину было рассчитано с использованием программного обеспечения Odyssey Fc Imager (LI-COR, США).
2.7. Выявление экспрессии мРНК, связанной с аутофагией, с помощью ОТ-КПЦР
Тотальную РНК выделяли из ткани почки с использованием реагента для экстракции тотальной РНК (метод Trizol). Полученную суммарную РНК подвергали обратной транскрипции с использованием набора для обратной транскрипции и набора для амплификации (Takara, Далянь, Китай) в соответствии с инструкциями производителя, а затем подвергали реакции амплификации в Applied Biosystems 7500 (ABI, США). Реакция синтеза кДНК обратной транскрипции и реакции амплификации составляли 20 мкл. Уровни экспрессии мРНК LC3B, Beclin1, GRP78 и CHOP рассчитывали и количественно анализировали с использованием 2-ΔΔCT с GAPDH в качестве гена внутреннего контроля. Праймеры были разработаны и синтезированы компанией ООО Sangon Biotech (Шанхай, Китай), а последовательности праймеров показаны в таблице 1.
Таблица 1
Последовательности праймеров в ОТ-КПЦР.
| Название гена | Прямая последовательность (5'→3') | Обратная последовательность (5'→3') |
| LC3B | GCTAACCAAGCCTTCTTCCTCCTG | TCTCTTCCTGTTGCTGTTGCCTTC |
| BECN1 | AGGAGTTGCCGTTGTACTGTTCTG | TGCCTCCAGTGTCTTCAATCTTGC |
| GRP78 | CGGAGGAGGAGGACAAGAAGGAG | ATACGACGGTGTGATGCGGTTG |
| CHOP | CCTCGCTCTCCAGATTCCAGTCAG | TCTCCTGCTCCTTCTCCTTCATGC |
| GAPDH | GACATGCCGCCTGGAGAAAC | AGCCCAGGATGCCCTTTAGT |
2.8. Метод флуоресцентного окрашивания in situ (TUNEL)
Почечный апоптоз оценивали с использованием метода ник-концевого мечения dUTP при помощи терминальной деоксинуклеотидил трансферазы (TUNEL) в соответствии с инструкциями набора (Meliunbio, Далянь, Китай). TUNEL-положительные клетки подсчитывали в пяти случайных полях при увеличении в 100 раз под флуоресцентным микроскопом. Апоптотический индекс выражали как процент TUNEL-положительных клеток в каждой области к общему количеству клеток.
2.9. СТАТИСТИЧЕСКИЙ АНАЛИЗ
Статистический анализ проводили с использованием программного обеспечения SPSS 23.0. Все данные выражены как среднее ± стандартное отклонение (среднее ± SEM). Сравнение двух независимых выборок проводилось с использованием t-критерия для независимых выборок. Для сравнения между группами использовался односторонний анализ ANOVA, а для сравнения между группами использовался тест LSD. Статистическая значимость рассматривалась при p <0,05.
3. Результаты
3.1. ИЗМЕНЕНИЯ МАССЫ ТЕЛА, МАССЫ ПОЧКИ И ОТНОСИТЕЛЬНОГО ВЕСА ОРГАНОВ КРЫС
Отношение массы почки к массе тела было значительно выше в группе ЭГ, чем в группе НК. Между тем отношение массы почки к массе тела было значительно ниже в группе АТО, но значительно выше в группе ДЭТК, чем в группе ЭГ (таблица 2).
Таблица 2
Изменения массы тела, массы почек и относительной массы органов у крыс.
| Группа | Масса тела (г) | Масса почки (г) | Индекс массы почки/тела (x10-3) |
| НК | 376,80 ± 28,99 | 1,40 ± 0,13 | 7,43 ± 0,25 |
| ЭГ | 332,38 ± 54,08 | 1,33 ± 0,15 | 8,09 ± 0,74* |
| ATO | 344,25 ± 32,47 | 1,09 ± 0,08 | 6,34 ± 0,35### |
| ДЭТК | 188,36 ± 30,09 | 1,13 ± 0,13 | 12,11 ± 0,79### |
Примечания: результаты представлены в виде среднего ± SEM. Данные анализировались с помощью одностороннего анализа ANOVA с последующими тестами LSD.
* р <0,05 по сравнению с группой нормального контроля,
# p <0,05, ## p <0,01 и ### p <0,001 в зависимости от группы с нефролитиазом.
3.2. ИЗМЕНЕНИЯ В АКТИВНОСТИ СОД
Как показано в таблице 3, активность СОД была ниже в группе ЭГ, чем в интактной контрольной группе. Кроме того, активность СОД была выше в группе АТО, но ниже в группе ДЭТК, чем в группе ЭГ (таблица 3).
3.3. Экспрессия мРНК LC3B и BECN1 в почках крыс
Относительные уровни экспрессии мРНК LC3B в группах ЭГ, ATO и ДЭТК были выше в (1,39 ± 0,20) раза, (0,65 ± 0,12) раза и (1,87 ± 0,21) раза по сравнению с группой НК. Экспрессия LC3B в группе ЭГ была значительно выше, чем в группе НК. Экспрессия LC3B была ниже в группе АТО, но выше в группе ДЭТК, чем в группе ЭГ (рис. 1-А). Относительные уровни экспрессии мРНК BECN1 в группах ЭГ, АТО и ДЭТК были в (1,55 ± 0,29) раза, (1,15 ± 0,15) раза и (1,96 ± 0,21) раза выше по сравнению с группой НК. Экспрессия BECN1 в группе ЭГ была значительно выше, чем в группе НК. Экспрессия BECN1 была ниже в группе АТО, но выше в группе ДЭТК, чем в группе ЭГ (рис. 1-Б).
3.4. Экспрессия белков, связанных с аутофагией, в почках крыс
Вестерн-блот анализ показал, что уровни экспрессии белка LC3II / I и BECN1 были значительно выше, а экспрессия белка p62 была значительно ниже в группе ЭГ, чем в группе НК. По сравнению с группой ЭГ, группа ДЭТК показала более высокую экспрессию LC3II / I и BECN1 и более низкую экспрессию p62, тогда как группа ATO показала более низкую экспрессию LC3II / I и BECN1 и более высокую экспрессию p62 (рис. 1-C) и D).
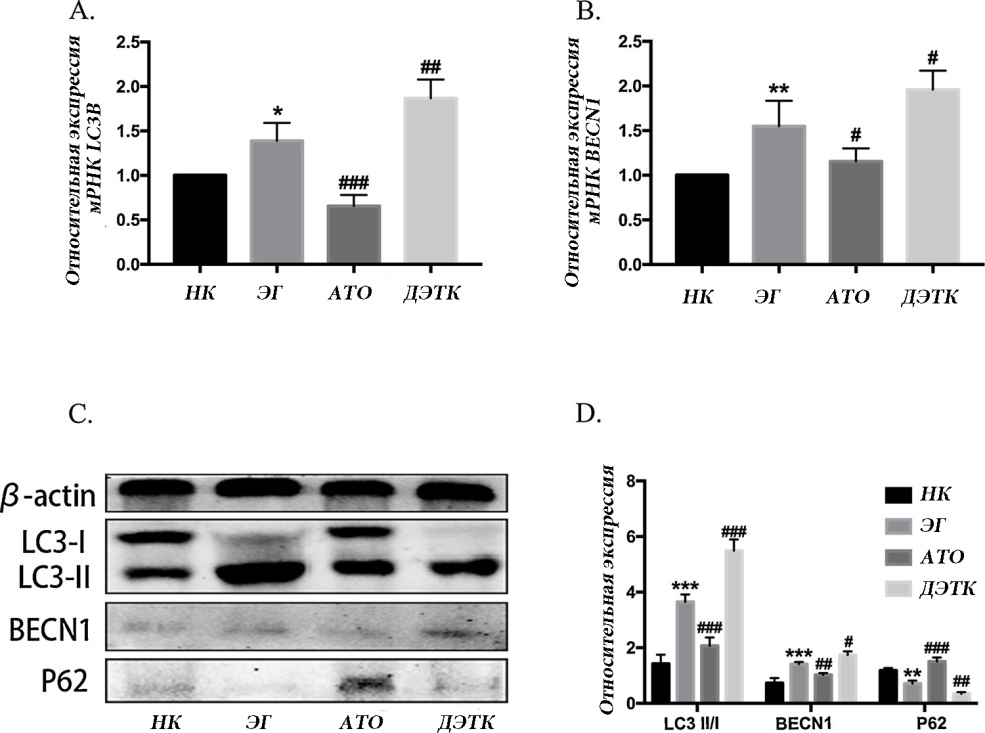
Рис. 1. Экспрессия белков, связанных с аутофагией и мРНК. A, B: относительные уровни экспрессии мРНК LC3B и BECN1, обнаруженные с помощью ОТ-ПЦР; С: репрезентативные полосы белка LC3B, BECN1 и P62 с помощью вестерн-блоттинга; D: количественный анализ белка LC3 II / I, BECN1 и P62 (* р <0,05, ** р <0,01 и
*** р <0,001 по сравнению с группой нормального контроля;
#p <0,05, ## p <0,01 и ### p <0,001
против группы с нефролитиазом.).
3.5. ИММУНОГИСТОХИМИЧЕСКОЕ ОБНАРУЖЕНИЕ ЭКСПРЕССИИ LC3B И BECN1 В ПОЧКАХ КРЫСЫ
Результаты иммуногистохимического окрашивания показали, что уровни экспрессии мРНК и белка LC3B, BECN1 и p62 были постоянными. По сравнению с группой НК группа ЭГ показала более высокую экспрессию LC3B и BECN1; по сравнению с группой ЭГ группа ATO демонстрировала более низкую экспрессию LC3B и BECN1, тогда как группа ДЭТК демонстрировала более высокую экспрессию LC3B и BECN1 (рис. 2-A-C).
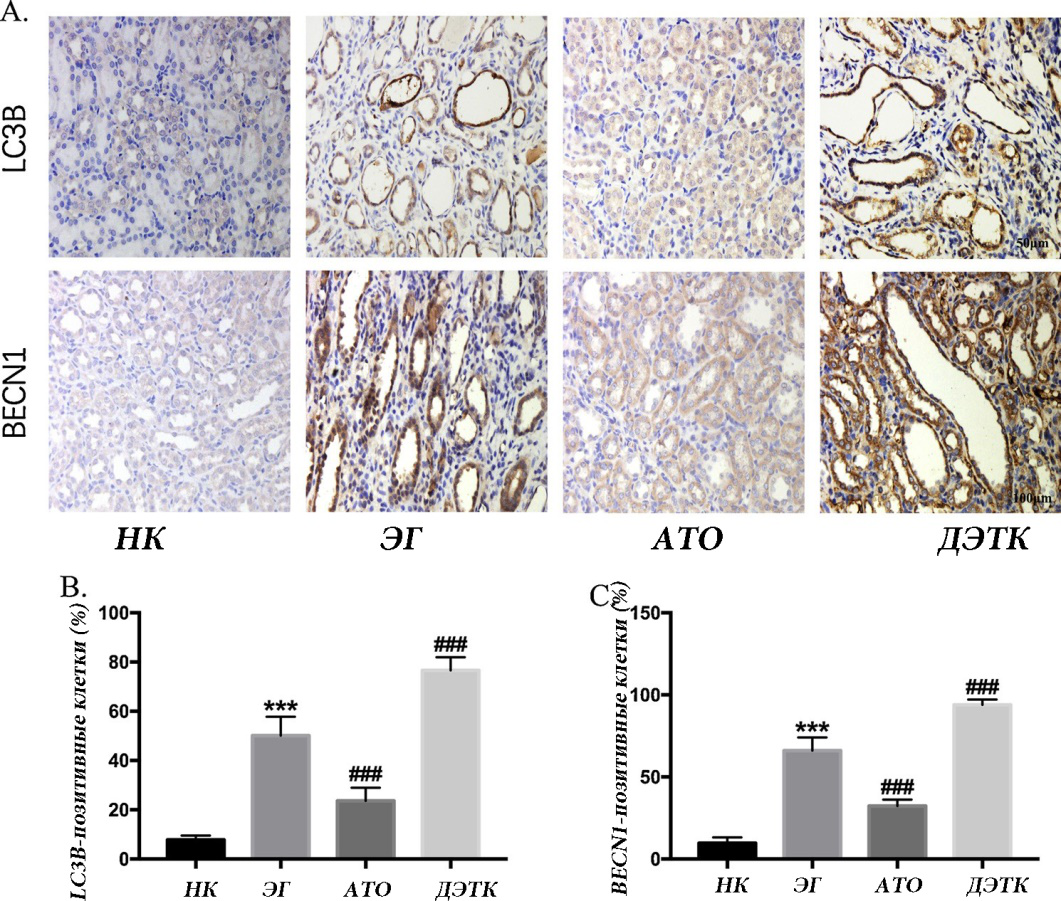
Рис. 2. Экспрессия белков, связанных с аутофагией, при иммуногистохимическом окрашивании. A: Экспрессия LC3B и BECN1 в почечных тканях крыс с помощью различных обработок, обнаруженных с помощью иммуногистохимического окрашивания; B, C: количественный анализ LC3B- и BECN1-позитивных клеток, обнаруженных иммуногистохимическим окрашиванием (*** p <0,001 по сравнению с группой нормального контроля; ### p <0,001 по сравнению с группой с нефролитиазом).
3.6. Экспрессия мРНК GRP78 и CHOP в почках крысы
Относительные уровни экспрессии мРНК GRP78 в группах ЭГ, АТО и ДЭТК были в (2,07 ± 0,31) раза, (1,40 ± 0,29) раза и (2,56 ± 0,22) раза выше по сравнению с группой НК. Экспрессия GRP78 в группе ЭГ была значительно выше, чем в группе НК. Экспрессия GRP78 была ниже в группе АТО, но выше в группе ДЭТК, чем в группе ЭГ (рис. 3-А). Относительные уровни экспрессии мРНК CHOP в группах ЭГ, АТО и ДЭТК были в (1,88 ± 0,26) раза, (1,35 ± 0,19) раза и (2,63 ± 0,11) раза выше по сравнению с группой НК. Экспрессия CHOP в группе ЭГ была значительно выше, чем в группе НК. Экспрессия CHOP была ниже в группе АТО, но выше в группе ДЭТК, чем в группе ЭГ (рис. 3-Б).
3.7. Экспрессия СЭР-связанных белков в почках крыс
Вестерн-блот анализ показал, что уровни экспрессии белка GRP78 и CHOP были значительно выше в группе ЭГ, чем в группе НК. По сравнению с группой ЭГ, группа ДЭТК показала более высокую экспрессию GRP78 и CHOP, тогда как группа ATO показала более низкую экспрессию GRP78 и CHOP (рис. 3-C и D).
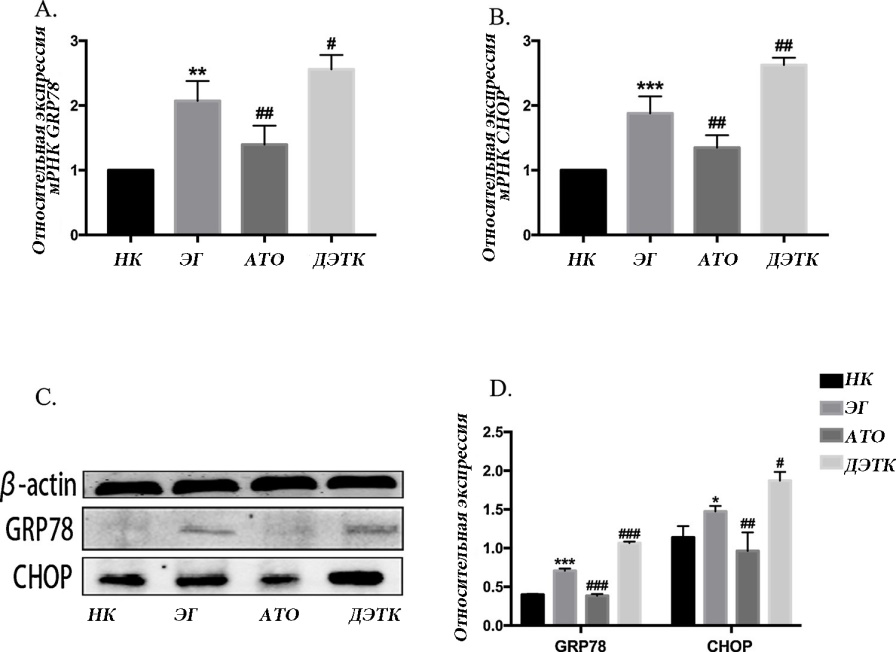
Рис. 3. Экспрессия СЭР-родственных белков и мРНК. A, B: относительные уровни экспрессии мРНК GRP78 и CHOP, обнаруженные с помощью ОТ-ПЦР; С: репрезентативные полосы экспрессии белков GRP78 и CHOP при вестерн-блоттинге; D: количественный анализ экспрессии белка GRP78 и CHOP (* p <0,05, ** p <0,01 и *** p <0,001 по сравнению с группой нормального контроля; #p <0,05, ## p <0,01 и ### p <0,001 по сравнению с группой с нефролитиазом.).
3.8. Изменения функции почек
Результаты автоматического анализа клинических параметров показали, что содержание КРЕ и АМК в группе ЭГ было значительно выше, чем в группе НК. По сравнению с группой ЭГ в группе АТО были более низкие содержания КРЕ и АМК, тогда как в группе ДЭТК - более высокие содержания КРЕ и АМК (таблица 3).
Таблица 3
Изменения в активности СОД и почечной функции.
| Группа | СОД (Ед / мл) | КРЕ (мкмоль / л) | АМК (ммоль / л) |
| НК | 99,88 ± 3,14 | 24,90 ± 2,75 | 5,66 ± 0,83 |
| ЭГ | 62,00 ± 5,66*** | 45,04 ± 2,85*** | 13,78 ± 1,05*** |
| ATO | 78,8 ± 7,55### | 28,30 ± 3,30### | 7,85 ± 0,58### |
| ДЭТК | 47,75 ± 8,36### | 66,03 ± 3,27### | 18,31 ± 1,22### |
Примечания: результаты представлены в виде среднего ± SEM. Данные анализируются с помощью одностороннего анализа ANOVA с последующими тестами LSD.
*** р <0,05 по сравнению с группой нормального контроля,
### p <0,001 по сравнению с группой с нефролитиазом.
3.9. Изменения факторов повреждения почки Kim-1 И NGAL
Уровни Kim-1 и NGAL в моче группы ЭГ были значительно выше, чем в группе НК. По сравнению с группой ЭГ, группа ДЭТК содержала более высокие уровни Kim-1 и NGAL в моче, тогда как группа ATO содержала значительно более низкие уровни Kim-1 и NGAL (рис. 4-A и B).
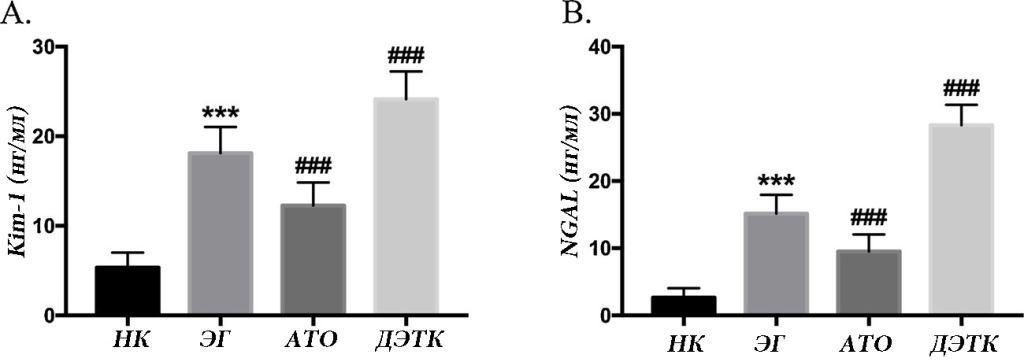
Рис. 4. Обнаружение маркеров повреждения почечных канальцев NGAL и Kim-1. Уровни NGAL и Kim-1 в моче измеряли с использованием набора для иммуноферментного анализа (ИФА). (*** p <0,001 по сравнению с группой нормального контроля; ### p <0,001 по сравнению с группой с нефролитиаза).
3.10. Определение апаптоза
Результаты окрашивания TUNEL показали, что количество TUNEL-позитивных клеток в группе ЭГ было выше, чем в группе НК. Кроме того, в группе АТО было меньше апоптотических клеток, в то время как в группе ДЭТК было больше TUNEL -позитивных клеток, чем в группе ЭГ (рис. 5-А и В).
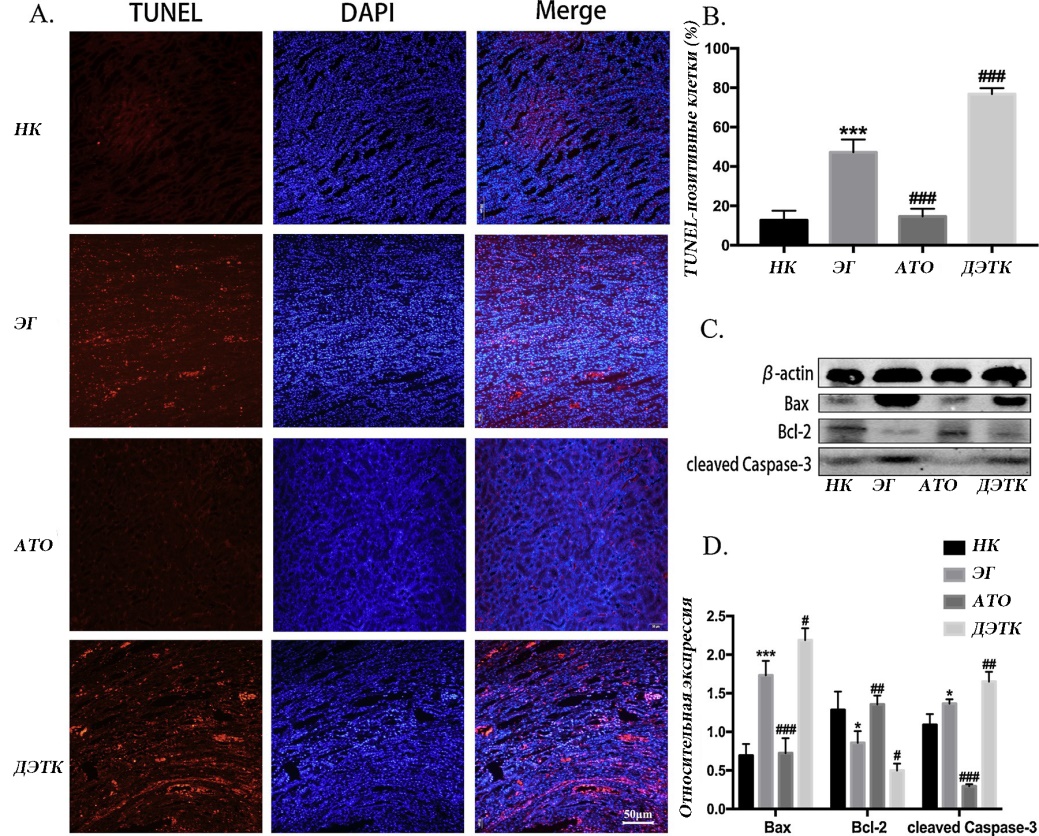
Рис. 5. Обнаружение апоптоза. A: Типичное окрашивание TUNEL показало количество TUNEL-позитивных клеток в тканях почек из каждой группы; B: количественный анализ TUNEL-положительных клеток в каждой группе путем окрашивания TUNEL. С: репрезентативные полосы экспрессии белков Bax, Bcl-2 и расщепленной каспазы-3 методом вестерн-блоттинга; D: количественный анализ экспрессии белков Bax, Bcl-2 и расщепленной каспазы-3 (** p <0,01 и *** p <0,001 по сравнению с группой нормального контроля; #p <0,05, ## p <0,01 и ## #p <0,001 по сравнению с группой с нефролитиазом).
3.11. Экспрессия белков, связанных с апоптозом, в почках крыс
Вестерн-блот анализ показал, что экспрессия белка Bax и расщепленной каспазы-3 была значительно выше, а экспрессия белка Bcl-2 была значительно ниже в группе ЭГ, чем в группе НК. По сравнению с группой ЭГ, группа ДЭТК показала более высокую экспрессию Bax и расщепленной каспазы-3, и более низкую экспрессию Bcl-2, тогда как группа ATO показала более низкую экспрессию Bax и более высокую экспрессию Bcl-2 (Рисунок 5-C и D).
3.12. АНАЛИЗ КРИСТАЛЛИЧЕСКОГО ОТЛОЖЕНИЯ И ГИСТОПАТОЛОГИЧЕСКИХ ИЗМЕНЕНИЙ ПОЧКИ
Окрашивание по Von Kossa показало, что морфология почечной ткани в группе НК была нормальной и патологических изменений не наблюдалось. По сравнению с группой НК, группа ЭГ имела значительно более высокое образование кристаллов, а в области коры отложений было больше, чем в области мозгового слоя. Кроме того, в группе ЭГ наблюдались различные степени дилатации канальцев и клубочковой дегенерации. После обработки АТО осаждение кристаллов значительно уменьшилось, гистопатологические изменения улучшились, а обработка ДЭТК усугубила осаждение кристаллов и гистопатологические изменения (рис. 6).
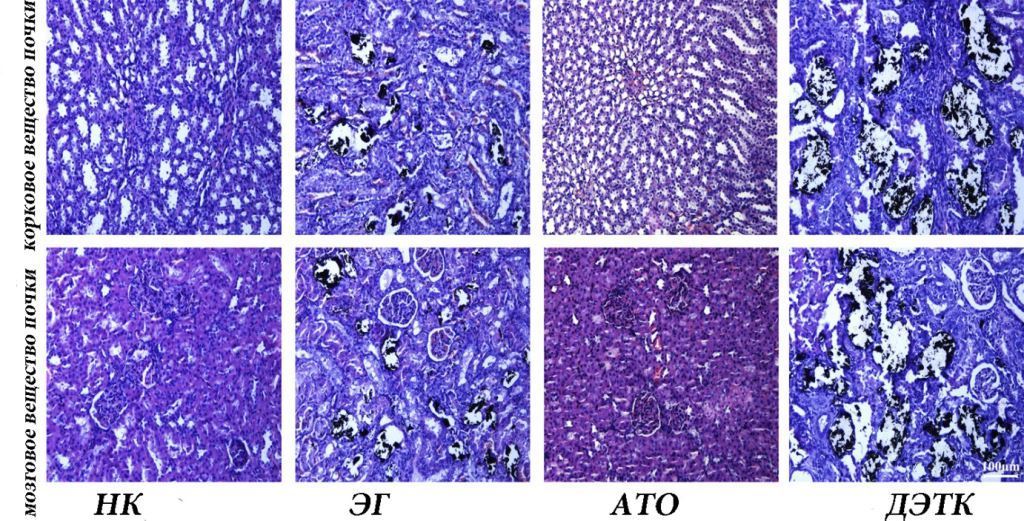
Рис. 6. Анализ осаждения кристаллов и гистопатологических изменений в почках. Типичное окрашивание по Von Kossa показало отложение кристаллов CaOx и повреждение почечных канальцев и клубочков в коре и мозговом веществе почек.
4. Обсуждение
Являясь частью врожденной иммунной системы, АФК участвует в нейтрофильных респираторных выбросах при окислительном стрессе и сигнализирует о месте воспаления при хемотаксисе воспалительных клеток [16,17]. СОД является необходимым ферментом для устранения супероксидных радикалов. Он специально используется для удаления АФК и ускорения мутации супероксидных анион-радикалов, таким образом защищая клетки от вредных побочных продуктов аэробных метаболитов и становясь первой линией защиты от АФК. Чтобы справиться с повреждением АФК и поддерживать окислительно-восстановительный гомеостаз, предыдущие исследования усиливали активность СОД для быстрого удаления избыточного АФК для нормальной функции клеток и выживания хозяина [18–20].
Кристаллы CaOx могут индуцировать выработку АФК в эпителиальных клетках почечных канальцев, а затем высвобождать воспалительные факторы за счет АФК-опосредованной активации аутофагии-СЭР-ответа, увеличивать повреждение эпителиальных клеток почечных канальцев и агрегацию кристаллов и в конечном итоге способствовать образованию внутрипочечных кристаллов. Ингибирование реакции аутофагии-СЭР может эффективно снижать повреждение окислительного стресса, вызванное кристаллами CaOx в эпителиальных клетках почечных канальцев, уменьшить индуцированное ЭГ отложение внутрипочечных кристаллов и высвобождение воспалительных факторов и щавелевой кислоты для ингибирования образования внутрипочечных кристаллов [3,7,21]. СОД играет важную роль при раке, диабете и различных воспалительных заболеваниях [22–25]. Усиление активности СОД может также уменьшить образование кристаллов почечного камня и минимизировать повреждение почек [26, 27]. Таким образом, мы предположили, что почечный защитный эффект СОД в формировании оксалатных камней в почках может быть достигнут путем регуляции аутофагического ответа СЭР.
При моделировании образования оксалатных почечных камней у крыс экспрессия LC3B, BECN1, GRP78 и CHOP увеличилась, экспрессия P62 уменьшилась, активность СОД снизилась, уровни маркеров повреждения почек Kim-1 и NGAL значительно увеличились, и размер кристаллов в почке также возрос. ЭГ индуцирует образование почечных камней из оксалата кальция у крыс и активирует реакцию аутофагии-СЭР в почках, вызывая повреждение почек. По сравнению с контрольной группой нефролитиаза после применения ДЭТК для ингибирования активности СОД уровень аутофагии-СЭР-ответа был значительно увеличен, повреждение почек усиливалось, а внутрипочечное отложение кристаллов еще больше увеличилось; группа АТО показала противоположные результаты. Таким образом, мы заключаем, что СОД может ингибировать реакцию аутофагии-СЭР путем непропорционально деградации АФК, эффективно снижать повреждение почек и уменьшать отложение кристаллов, индуцированных ЭГ, в почках у крыс,.
Апоптоз и аутофагия являются важными молекулярными механизмами, которые поддерживают клеточный гомеостаз в условиях стресса и имеют решающее значение для выживания и гибели клеток. PI3K / AKT и BECN1 взаимодействуют с BAX / BAK и антиапоптотическим белком BCL2 для совместной регуляции аутофагии и апоптоза [28,29]. В настоящем исследовании осаждение кристаллов почек в группе ЭГ индуцировало одновременную аутофагию и апоптоз с активацией BECN1, расщеплением каспазы-3 и BAX и подавлением антиапоптотического белка BCL2. ДЭТК подавлял активность СОД и увеличивал апоптоз эпителиальных клеток почечных канальцев, в то время как АТО значительно снижал апоптоз [30–32].
В настоящее время имеются сообщения об ответе аутофагии-СЭР в области гепатобилиарной и респираторной патологии, но все еще существуют различные мнения относительно различных способов регуляции аутофагии с помощью СЭР [33,34]. Некоторые ученые отмечают, что его регуляция может быть вызвана такими факторами, как PERK / eIF2α, IRE1α и ATF6 [35,36]. Также хорошо известно, что СОД играет решающую роль в деградации АФК при окислительном стрессе, следовательно, есть вероятность, что СОД также может регулировать эти факторы и играет роль в реакции аутофагии-СЭР путем деградации АФК, что заслуживает нашего дальнейшего изучения. В то же время, из-за важной роли PI3K / AKT как в аутофагии, так и в апоптозе, мы также предполагаем, что СОД с высокой вероятностью регулирует реакцию аутофагии-СЭР через PI3K / AKT.
АТО представляет собой класс ингибиторов гидроксимеглутарил кофермента А редуктазы и является препаратом, снижающим уровень липидов статинов. Помимо снижения уровня холестерина и липопротеинов в плазме крови и снижения выработки ЛПНП, АТО также оказывает статиновые плейотропные эффекты, а именно влияет на улучшение эндотелиальной функции сосудов, а также имеет противовоспалительные и антиоксидантные эффекты [37–39]. Tsujihata с соавт [12,13] также предположили, что АТО может ингибировать удержание внутрипочечных кристаллов, усиливая активность СОД. В этом исследовании мы продемонстрировали, что АТО может эффективно ингибировать реакцию аутофагии-СЭР, индуцированную в процессе образования кристаллов кальциево-оксалатного камня, и значительно уменьшить отложение кристаллов и повреждение почек на крысиной модели почечных камней. Эти результаты показывают, что ATO может использоваться для уменьшения повреждения почек и образования камней в почках, обеспечивая новую стратегию профилактики и лечения камней в почках.
5. Вывод
Повышение уровня СОД может уменьшить образование CaOx нефролитиаза на крысиной модели ЭГ и уменьшить повреждение эпителиальных клеток почечных канальцев. Механизм может осуществляться через разложение АФК, тем самым ингибируя реакцию аутофагии-СЭР.
АТО может уменьшить повреждение почек и предотвратить образование почечных камнейв, регулируя активность СОД и реакцию аутофагии-СЭР. Тем не менее, конкретный путь, по которому СОД регулирует реакцию аутофагии-СЭР, все еще нуждается в дальнейших исследованиях.
Источники финансирования
Это исследование было поддержано Национальным фондом естественных наук Китая (81760127 и 81960138), Фондом естествознания Guangxi по гранту (№ 2018GXNSFBA138011 и No.2017GXNSFAA198070), Программой ключевых исследований и разработок Фонда естественных наук Гуанси (AB16380225).
[1] J.B. Ziemba, B.R. Matlaga, Epidemiology and economics of nephrolithiasis, Investig. Clin. Urol. 58 (5) (2017), https://doi.org/10.4111/icu.2017.58.5.299.
[2] S.R. Khan, M.S. Pearle, W.G. Robertson, et al., Kidney stones, Nat. Rev. Dis. Primers 2 (2016) 16008, https://doi.org/10.1038/nrdp.2016.8.
[3] Y. Liu, Q. Liu, X. Wang, et al., Inhibition of autophagy attenuated ethylene glycol induced crystals deposition and renal injury in a rat model of Nephrolithiasis, Kidney Blood Press. Res. 43 (1) (2018) 246–255, https://doi.org/10.1159/ 000487678.
[4] D.J. Klionsky, K. Abdelmohsen, A. Abe, et al., Guidelines for the use and inter- pretation of assays for monitoring autophagy (3rd edition), Autophagy 12 (1) (2016) 1–222, https://doi.org/10.1080/15548627.2015.1100356.
[5] C.Y. Li, Y.L. Deng, B.H. Sun, Taurine protected kidney from oxidative injury through mitochondrial-linked pathway in a rat model of nephrolithiasis, Urol. Res. 37 (4) (2009) 211–220, https://doi.org/10.1007/s00240-009-0197-1.
[6] C.Y. Li, Y.L. Deng, B.H. Sun, Effects of apocynin and losartan treatment on renal oxidative stress in a rat model of calcium oxalate nephrolithiasis, Int. Urol. Nephrol. 41 (4) (2009) 823–833, https://doi.org/10.1007/s11255-009-9534-0.
[7] Y. Liu, D. Li, Z. He, et al., Inhibition of autophagy-attenuated calcium oxalate crystal- induced renal tubular epithelial cell injury in vivo and in vitro, Oncotarget 9 (4) (2018) 4571–4582, https://doi.org/10.18632/oncotarget.23383.
[8] E. Delbrel, A. Soumare, A. Naguez, et al., HIF-1α triggers ER stress and CHOP-
mediated apoptosis in alveolar epithelial cells, a key event in pulmonary fibrosis, Sci. Rep. 8 (1) (2018), https://doi.org/10.1038/s41598-018-36063-2.
[9] W. Zheng, B. Wang, M. Si, et al., Zearalenone altered the cytoskeletal structure via ER stress- autophagy-oxidative stress pathway in mouse TM4 Sertoli cells, Sci. Rep. 8 (1) (2018), https://doi.org/10.1038/s41598-018-21567-8.
[10] L.A. Lawrence, J.K. Mulligan, C. Roach, et al., Superoxide dismutase reduces the inflammatory response to Aspergillus and Alternaria in human sinonasal epithelial cells derived from patients with chronic rhinosinusitis, Am. J. Rhinol. Allergy 29 (2) (2015) 89–93, https://doi.org/10.2500/ajra.2015.29.4155.
[11] M.B. Iversen, R.H. Gottfredsen, U.G. Larsen, et al., Extracellular superoxide dis- mutase is present in secretory vesicles of human neutrophils and released upon stimulation, Free Radic. Biol. Med. 97 (2016) 478–488, https://doi.org/10.1016/j. freeradbiomed.2016.07.004.
[12] M. Tsujihata, C. Momohara, I. Yoshioka, et al., Atorvastatin inhibits renal crystal retention in a rat stone forming model, J. Urol. 180 (5) (2008) 2212–2217, https:// doi.org/10.1016/j.juro.2008.07.024.
[13] M. Tsujihata, I. Yoshioka, A. Tsujimura, et al., Why does atorvastatin inhibit renal crystal retention? Urol. Res. 39 (5) (2011) 379–383, https://doi.org/10.1007/ s00240-011-0370-1.
[14] R. Maio, B. Sepodes, N. Figueiredo, et al., Effects of diethyldithiocarbamate (DETC) on liver injury induced by ischemia-reperfusion in rats, Transplant. Proc. 39 (2007) 365–368, https://doi.org/10.1016/j.transproceed.2007.01.004.
[15] J. Hada, T. Kaku, M.H. Jiang, et al., Sodium nitroprusside-induced seizure and taurine release from rat hippocampus, Amino Acids 19 (3-4) (2000) 547–559.
[16] C. Bogdan, M. Röllinghoff, Reactive oxygen and reactive nitrogen intermediates in innate and specific immunity, Curr. Opin. Immunol. 12 (1) (2000) 64–76.
[17] T. Fukai, M. Ushio-Fukai, Superoxide dismutases: role in redox signaling, vascular function, and diseases, Antioxid. Redox Signal. 15 (6) (2011) 1583–1606, https:// doi.org/10.1089/ars.2011.3999.
[18] B. Mansuroğlu, S. Derman, A. Yaba, et al., Protective effect of chemically modified SOD on lipid peroxidation and antioxidant status in diabetic rats, Int. J. Biol. Macromol. 72 (2015) 79–87, https://doi.org/10.1016/j.ijbiomac.2014.07.039.
[19] X. Lu, C. Wang, B. Liu, The role of Cu/Zn-SOD and Mn-SOD in the immune response to oxidative stress and pathogen challenge in the clam Meretrix meretrix, Fish Shellfish Immunol. 42 (1) (2015) 58–65, https://doi.org/10.1016/j.fsi.2014.10. 027.
[20] R.G. Alscher, N. Erturk, Role of superoxide dismutases (SODs) in controlling oxi- dative stress in plants, J. Exp. Bot. 53 (372) (2002) 1331–1341.
[21] J. Zhao, J. Cheng, C. Li, et al., Ethyl pyruvate attenuates CaCl2-Induced tubular epithelial cell injury by inhibiting autophagy and inflammatory responses, Kidney Blood Press. Res. 43 (5) (2018) 1585–1595, https://doi.org/10.1159/000494445.
[22] M. Hubackova, R. Vaclavikova, M. Ehrlichova, et al., Association of superoxide dismutases and NAD(P)H quinone oxidoreductases with prognosis of patients with breast carcinomas, Int. J. Cancer 130 (2) (2012) 338–348, https://doi.org/10. 1002/ijc.26006.
[23] M.L. Teoh-Fitzgerald, M.P. Fitzgerald, W. Zhong, et al., Epigenetic reprogramming governs EcSOD expression during human mammary epithelial cell differentiation, tumorigenesis and metastasis, Oncogene 33 (3) (2014) 358–368, https://doi.org/ 10.1038/onc.2012.582.
[24] H. Jung, Y.Y. Kim, B. Kim, et al., Improving glycemic control in model mice with type 2 diabetes by increasing superoxide dismutase (SOD) activity using silk fibroin hydrolysate (SFH), Biochem. Biophys. Res. Commun. 493 (1) (2017) 115–119, https://doi.org/10.1016/j.bbrc.2017.09.066.
[25] G. Xu, K. Luo, H. Liu, et al., The progress of inflammation and oxidative stress in patients with chronic kidney disease, Ren. Fail. 37 (1) (2015) 45–49, https://doi. org/10.3109/0886022X.2014.964141.
[26] T. Kizivat, M. Smolić, I. Marić, et al., Antioxidant pre-treatment reduces the toxic effects of oxalate on renal epithelial cells in a cell culture model of Urolithiasis, Int.
J. Environ. Res. Public Health 14 (1) (2017), https://doi.org/10.3390/ ijerph14010109.
[27] N. Partovi, M.R. Ebadzadeh, S.J. Fatemi, et al., Effect of fruit extract on renal stone formation and kidney injury in rats, Nat. Prod. Res. 32 (10) (2018) 1180–1183, https://doi.org/10.1080/14786419.2017.1320790.
[28] O. Oral, Y. Akkoc, O. Bayraktar, Physiological and pathological significance of the molecular cross-talk between autophagy and apoptosis, Histol. Histopathol. 31 (5) (2016) 479–498, https://doi.org/10.14670/HH-11-714.
[29] K. Nowikovsky, Autophagy regulates apoptosis on the level of the death-inducing signalling complex, FEBS J. 284 (13) (2017) 1967–1969, https://doi.org/10.1111/ febs.14119.
[30] A. Barbe, C. Ramé, N. Mellouk, et al., Effects of grape seed extract and proantho- cyanidin B2 on in vitro proliferation, viability, steroidogenesis, oxidative stress, and cell signaling in human granulosa cells, Int. J. Mol. Sci. 20 (17) (2019), https://doi. org/10.3390/ijms20174215.
[31] Y. Zhu, W. Zuo, L. Chen, et al., Repurposing of the anti-helminthic drug niclosamide to treat melanoma and pulmonary metastasis via the STAT3 signaling pathway, Biochem. Pharmacol. (2019), https://doi.org/10.1016/j.bcp.2019.08.012.
[32] Q. Liu, Y. Liu, X. Guan, et al., Effect of M2 macrophages on injury and apoptosis of renal tubular epithelial cells induced by calcium oxalate crystals, Kidney Blood Press. Res. 44 (2019) 777–791, https://doi.org/10.1159/000501558.
[33] B. He, Q. Chen, D. Zhou, et al., Role of reciprocal interaction between autophagy and endoplasmic reticulum stress in apoptosis of human bronchial epithelial cells induced by cigarette smoke extract, IUBMB Life 71 (1) (2019) 66–80, https://doi. org/10.1002/iub.1937.
[34] Z. Li, L. Zhang, M. Gao, et al., Endoplasmic reticulum stress triggers Xanthoangelol- induced protective autophagy via activation of JNK/c-Jun Axis in hepatocellular carcinoma, J. Exp. Clin. Cancer Res. 38 (1) (2019) 8, https://doi.org/10.1186/ s13046-018-1012-z.
[35] K.M. Rouschop, T. van den Beucken, L. Dubois, et al., The unfolded protein response protects human tumor cells during hypoxia through regulation of the autophagy genes MAP1LC3B and ATG5, J. Clin. Invest. 120 (1) (2010) 127–141, https://doi. org/10.1172/JCI40027.
[36] B. Ning, Q. Zhang, N. Wang, et al., Beta-asarone regulates ER stress and autophagy via inhibition of the PERK/CHOP/Bcl-2/Beclin-1 pathway in 6-OHDA-Induced parkinsonian rats, Neurochem. Res. 44 (5) (2019) 1159–1166, https://doi.org/10. 1007/s11064-019-02757-w.
[37] T.J. Stalker, A.M. Lefer, A new HMG-CoA reductase inhibitor, rosuvastatin, exerts anti-inflammatory effects on the microvascular endothelium: the role of mevalonic acid, Br. J. Pharmacol. 133 (3) (2001) 406–412.
[38] A. Cai, D. Zheng, Y. Dong, et al., Efficacy of Atorvastatin combined with adipose- derived mesenchymal stem cell transplantation on cardiac function in rats with acute myocardial infarction, Acta Biochim. Biophys. Sin. 43 (11) (2011) 857–866, https://doi.org/10.1093/abbs/gmr087.
[39] X. Ke, B. Ke, X. Wang, et al., Additive effects of atorvastatin combined with si- tagliptin on rats with myocardial infarction: a pilot study, Arch. Med. Sci. 4 (2017) 956–961, https://doi.org/10.5114/aoms.2017.68143.
