Аннотация. Целью данного исследования было изучение факторов риска развития синдрома системного воспалительного ответа после уретероскопической лазерной литотрипсии. Мы собрали ретроспективные данные 469 пациентов, перенесших уретероскопическую лазерную литотрипсию только в нашем учреждении с февраля 2008 года по июнь 2016 года. Были получены данные о пациентах, камнях и хирургических факторах, которые потенциально способствовали развитию послеоперационной инфекции. Используя модель логистической регрессии, мы проанализировали, как клинические факторы влияют на частоту возникновения синдрома системного воспалительного ответа. У двадцати семи пациентов (5,7%) диагностировали синдромом системного воспалительного ответа после операции; из них 25 пациентам диагноз поставили в течение 24 ч после уретероскопии. Один пациент нуждался в лечении в отделение интенсивной терапии, смертельных случаев не наблюдалось. Наличие стента перед операцией коррелировало с возникновением синдрома послеоперационного системного воспалительного ответа только при одномерном анализе, причины же стентирования были различными. Многомерный анализ показал, что такие факторы как обструктивный пиелонефрит, положительный результат предоперационного культурального исследования мочи из мочевого пузыря и женский пол были достоверно значимы для развития синдрома послеоперационного системного воспалительного ответа. Пациенты, у которых наблюдался обструктивный пиелонефрит, предшествующий уретероскопической лазерной литотрипсии, или положительный результат предоперационного посева мочи из мочевого пузыря, подвергались повышенному риску развития синдрома системного воспалительного ответа, несмотря на получение адекватной предоперационной антибактериальной терапии. Что же касается воздействия предоперационного стента на послеоперационную инфекцию, то необходимо провести дополнительное исследование с учетом причин, потребовавших стентирования.
Критерии ССВО
В соответствии с критериями, установленными в 1992 году Американской ассоциации врачей – специалистов по заболеваниям грудной полости / Комитетом по консенсусной клинической медицине, у пациентов с двумя или несколькими из следующих клинических критериев был диагностирован ССВО [9]: (1) температура тела выше 38 ° C или ниже 36oC; (2) частота сердечных сокращений выше 90 ударов в минуту или PaCO2 ниже 32 мм рт.ст.; (3) частота дыхания выше 20 вдохов в минуту; (4) количество лейкоцитов выше 12000 / мм3 или ниже 4000 / мм3; или наличие более 10% незрелых нейтрофилов.
Техника УС
УС выполняли в положении литотомии под общей или спинальной анестезией. Полужесткий уретероскоп (Fiber Uretero-Renoscope, Richard Wolf, Книттлинген, Германия) использовался главным образом для камней нижних отделов мочеточника, а гибкие волоконно-оптические или видеоуретероскопы (URF-P6 или URF-V2; Olympus, Токио, Япония) использовали для камней верхнего отдела мочеточника и почечных камней после установки мочеточникового кожуха (12/14 или 10/12 Fr ReTrace, Coloplast, Гумлебек, Дания). Камни были фрагментированы гольмием: YAG-лазером (VersaPulse, Lumenis, Тель-Авив, Израиль) и извлечены нитиноловой корзиной (Escape, Boston Scientific, Natick, Массачусетс, США). В конце операций во всех случаях использовались мочеточниковый стент 4,7-6 Fr и уретральный катетер 18 Fr.
Статистический анализ
Чтобы найти существенные факторы, связанные с ССВО, были использованы тесты Пирсона и Уилкоксона для сравнения пропорций между группой ССВО и группой без ССВО. Был проведен многовариантный логистический регрессионный анализ для определения прогнозирующих факторов риска пост-УС ССВО. Таким образом, переменные были ограничены теми данными, которые можно было получить до операции и во время операции. Переменные, которые были значительно связаны с пост-УС ССВО в одномерном анализе, были отобраны для многомерного анализа. При выполнении многомерного анализа непрерывная переменная была преобразована в двоичную переменную, основанную на медиане. Сила корреляции между различными факторами и ССВО определялась как коэфициент вероятности (КВ) и 95% доверительный интервал (ДИ). Все статистические тесты были двусторонними, результаты считались значимыми при p <0,05. Статистический анализ проводился с использованием JMP, версия 10.0 (SAS, Cary, Северная Каролина, США).
Результаты
Мы изучили результаты лечения 469 пациентов, которые перенесли успешную УС в течение периода исследования. В таблице 1 приводятся демографические данные о пациентах и камнях. Состав камней и ПМП были проанализированы у 460 пациентов. В общем и целом, у 100 пациентов (21,3%) наблюдался обструктивный пиелонефрит, предшествующий УС. Этим пациентам потребовалось дренирование верхних мочевых путей методом стентирования мочеточника или чрескожной нефростомии, а так же вводился антибиотик, специфичный для их микрофлоры. УС выполняли после того, как лечение пиелонефрита было завершено, на основании лабораторных данных и общего состояния пациента.
У сорока двух пациентов (8,9%) после УС развивалась лихорадка с температурой тела выше 38°C. У двадцати семи пациентов (5,7%) был диагностирован ССВО, среди них у 25 ССВО был диагностирован в течение 24 ч после УС. Одному пациенту потребовался перевод в ОРИТ из-за вазопрессорно-рефрактерного шока, однако смертельные случаи отсутствовали.
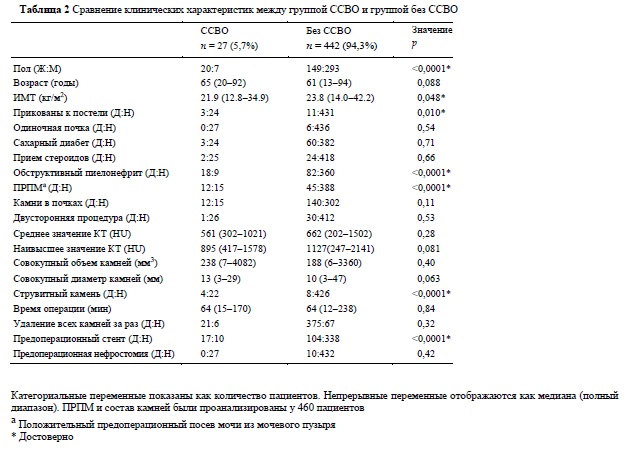
В таблице 2 показано сравнение между пациентами с пост-УС ССВО и пациентами без ССВО. При одномерном анализе такие параметры как женский пол, индекс массы тела (ИМТ), прикованность к постели, обструктивный пиелонефрит, предшествующий УС, положительный результат ПМП, магний-аммониум фосфатныем камни (MAФ) и наличие стента перед операцией достоверно коррелированы с развитием ССВО. Предоперационные стенты чаще имелись у пациентов из группы ССВО, чем у пациентов из группы без ССВО (62,9 против 23,5%, p <0,0001), но не было различий по показателю наличия предоперационной нефростомы (0 против 2,2%, p = 0,42). Продолжительность антибиотикопрофилактики до поступления была оставлена на усмотрение лечащих урологов, однако средняя ее продолжительность в группе ССВО и группе без ССВО оказалась примерно одинаковой и равной 6 дням. Средняя продолжительность нахождения стента в группе ССВО составляла 19 дней, а в группе без ССВО, - 22 дня.
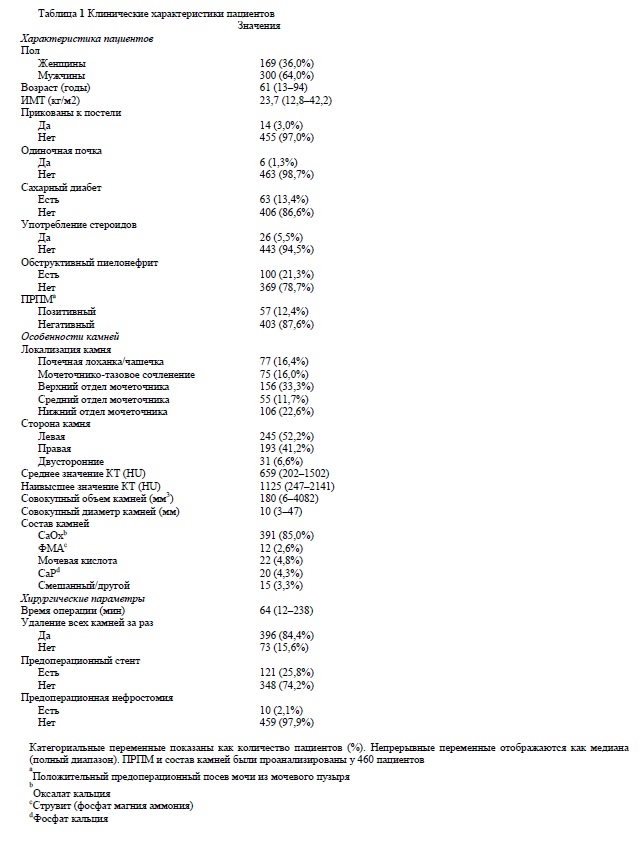
Достоверной разницы между двумя группами не было (p = 0,779).
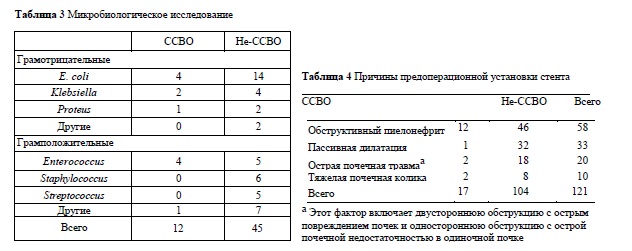
В таблице 3 перечислены патогены, идентифицированные при ПМП. Escherichia coli и Enterococcus в группе ССВО были наиболее распространенными. В таблице 4 приведены причины предоперационного стентирования; наиболее распространенной причиной в группе ССВО было дренирование при обструктивном пиелонефрите. Показанием к предоперационной нефростомии во всех случаях была необходимость дренирования почки при обструктивном пиелонефрите. Пациентам из группы ССВО потребовалось значительно более длительное время пребывания в больнице после УС, чем пациентам из группы без ССВО (в среднем 8 дней против 2 дней, р <0,0001).
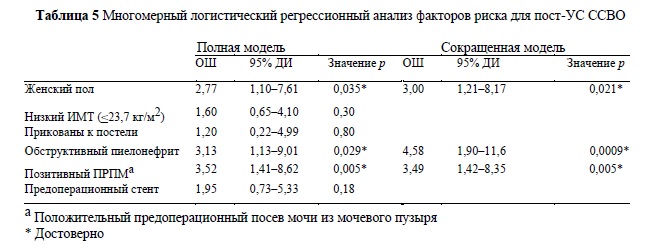
В таблице 5 показан многомерный анализ факторов, связанных с пост-УС ССВО. При сокращенной модели многомерного анализа предшествующий УС обструктивный пиелонефрит (КВ 4.58, 95% ДИ 1,90-11,6, p = 0,0009), положительный результат ПМП (КВ 3,49, 95% ДИ 1,42-8,35, p = 0,005) и женский пол (ОШ 3,00, 95% ДИ 1,21-8,17, p = 0,021) оставались достоверно значимыми факторами.
Обсуждение
Руководства Европейской ассоциации урологов (ЕАУ), касающиеся уролитиаза, рекомендуют ПНЛ в качестве метода первой линии в лечении почечных камней размером 2 см и более [10]; однако, опубликованы результаты нескольких исследованияй, проведенных на базе одного института, в которых для лечения крупных почечных камней использовали УС [11]. Наш первоначальный опыт проведения УС в случаях с большими почечными камнями показал успешные результаты с высокой частотой полного удаления камней, но при этом уровень инфекционных осложнений был значительным [12]. Skolarikos и др. сообщили, что 4,6% из 1210 пациентов, которым проводили УС для лечения одиночного почечного камня, имели камень более 20 мм. Авторы показали, что у пациентов с большими почечными камнями вероятность развития лихорадки после УС была более высокой[13]. С точки зрения высокого уровня полного удаления камней и низкой частоты осложнений, адекватный размер почечного камня, удаляемого методом УС вызывает споры, хотя имеются некоторые предложения [14]. Преимуществом УС является его минимально инвазивное воздействие, но мы должны знать о повышении риска более тяжелых осложнений с расширением применения УС.
Среди 469 пациентов, включенных в это исследование, у 27 пациентов (5,7%) был диагностирован пост-УС ССВО. Этот показатель согласуется с данными предыдущих исследований [6-8]. Хотя одному пациенту потребовалась госпитализация в ОРИТ, в течение периода исследования никто не умер от инфекции после УС. Это говорит о том, что ССВО не обязательно приводит к смертельному исходу, но тот факт, что группе пациентов с ССВО потребовалось значительно большее время лечения в больнице после УС, чем группе пациентов без ССВО, указывает на то, что пост-УС УСВВО налагает физическое и экономическое бремя на пациентов. Сравнение между пациентами с пост-УС ССВО и без ССВО позволило выделить факторы, потенциально связанные с развитием пост-УС ССВО: женский пол, более низкий ИМТ, состояние прикованности к постели, обструктивный пиелонефрит, положительный результат ПМП, струвитные камни и предоперационный стент. Многомерный анализ показал, что обструктивный пиелонефрит, положительный результат ПМП и женский пол были достоверно значимо связаны с пост-УС ССВО. В дальнейшем, среди этих результатов, мы сфокусируемся на следующих трех факторах риска: предоперационном стенте, прикованности пациента к постели и обструктивном пиелонефрите.
Мочеточниковый стент и чрескожная нефростома, установленные пациентам с обструктивным пиелонефритом, в нашем исследовании были проанализированы как отдельные потенциальные факторы риска. Оптимальный вид дренирования при обструктивном пиелонефрите еще не установлен. В предыдущих исследованиях сравнение между мочеточниковым стентом и чрескожной нефростомой фокусировалось главным образом на частоте осложнений, контроле за инфекцией и влиянии на качество жизни [15]. Однако, насколько нам известно, ни в одном исследовании не определяли, как два типа дренажа, установленных до операции, влияют на вероятность развития пост-ПНЛ или пост-УС инфекционных осложнений. В нашем одномерном анализе предоперационный стент был достоверно значимо связан с развитием пост-УС ССВО (р <0,0001), в то время как предоперационная нефростома не была (р = 0,42). В таблице 4 показано, что у 20,6% (12/58) пациентов, стентированных для дренирования при обструктивном пиелонефрите и 7,9 % (5/63) из тех, которые были стентированы по другим причинам, развивался пост-УС ССВО.
Мочеточниковый стент, который, как сообщается, подвержен колонизации бактерий на биопленке [16] и приводит к возникновению рефлюкса мочи из мочевого пузыря, может увеличивать риск развития пост-УС инфекции даже после лечения обструктивного пиелонефрита. С другой стороны, чрескожная нефростома может играть важную роль в поддержании хорошей интраоперационной ирригации и предотвращении высокого лоханочного давления. Эти утверждения контрастируют с результатами анализа аналогичной подгруппы в исследовании Blackmur и др., где указывается, что предоперационный стент может снизить риск развития пост-УС ССВО у пациентов с положительным результатом ПМП [6]. Однако предоперационный стент и нефростома не рассматривались ими как отдельные переменные, а точное количество предоперационных стентов и причины их установки не упоминались. Хотя влияние предоперационного стента на частоту инфицирования после УС еще предстоит определить, мы считаем, что знать о причинах установки стента крайне важно.
Прикованность к постели, исходя из одномерного анализа, также была достоверно связана с риском развития пост-УС ССВО. Несмотря на то, что этот фактор не оставался значимым при многофакторном анализе, мы считаем, что УС для прикованного к постели пациента следует проводить с особой осторожностью. Прикованные к постели пациенты с большей вероятностью имеют струвитные камни и положительный результат ПМП, часто с антибиотикоустойчивыми патогенами, а камни у них, чаще всего, будут расти бессимптомно. В этом исследовании положительный результат ПМП был независимым фактором риска для пост-УС ССВО при многофакторном анализе, а наличие MAФ-камня (струвитного) было значительно связано с пост-УС ССВО при однофакторном анализе. Эти комплексные факторы существенно усложняют периоперационный контроль за пациентами.
Негативное влияние низкого уровня активности на риск развития послеоперационной инфекций отмечалось и в предыдущих исследованиях [4, 17]. Martov и др. в исследовании CROES US Global Study показали, что женский пол, высокий показатель по шкале Американского общества анестезиологов (АОА), большая каменная масса, болезнь Крона и сердечно-сосудистые заболевания являются значимыми факторами риска послеоперационной ИМП или лихорадки у пациентов с отрицательным результатом исходного посева мочи. В настоящем исследовании мы не учитывали высокий балл АОА или параплегию как потенциальные факторы риска, поскольку мы считали, что долговременное состояние прикованности к постели в значительной степени способствует образованию камней и усложнению операций. Классификация АОА не может точно ограничить группу прикованных к постели пациентов, а прикованные к постели пациенты не обязательно параплегические.
Мы рассматривали обструктивный пиелонефрит, предшествующий УС, как наиболее важный фактор риска среди выявленных нами, поскольку его КВ был самым высоким при многофакторном анализе. В исследовании Kanno и др. сообщалось, что у 8% пациентов с обструктивным пиелонефритом и у 6% пациентов без обструктивного пиелонефрита после УС развивалась лихорадка или уросепсис, и их показатели существенно не различались [18]. Тем не менее, наблюдается тенденция к увеличению риска развития лихорадки после УС у пациентов, перенесших обструктивный пиелонефрит. В вышеупомянутом исследовании, проведенном Blackmur и др., анализ согласованных пар показал, что инфекция мочевых путей, требующая стационарного лечения в период до 90 дней перед УС, не влияла на частоту пост-УС ССВО [6]; Это не соответствовует нашим выводам. Их результаты, по-видимому, более убедительные из-за анализа согласованных пар и большого числа пациентов. Напротив, Youssef и др. показали, что у пациентов с сепсисом, предшествовавшим УС, был значительно более высокий уровень осложнений, более долгий период пребывания в стационаре, и они получали более длительный курс послеоперационной антибактериальной терапии [19]. Очевидно, что отсутствует консенсус относительно факторов риска инфицирования после УС, и это можно объяснить ограничениями ретроспективных исследований. В настоящее время требуется перспективное исследование риска развития инфекции после вмешательства на основании опыта нескольких институтов.
Число пациентов, включенных в наше исследование, было большим по сравнению с предыдущими исследованиями, включающими опыт одного института, но мы наблюдали относительно небольшое количество эпизодов ССВО. Сообщается, что встречаемость пост-УС инфекции ниже, чем пост-ПНЛ инфекции, из-за менее инвазивного характера этой процедуры, и, следовательно, при изучении пост-УС инфекции требуется большее число пациентов для получения статистически достоверных результатов. Таким образом, требуются дальнейшие исследования, проведенные в рамках нескольких институтов. Мы рассчитывали трехмерный общий объем камня с использованием формулы эллипсоида и предположили, что этот метод измерения приведет к более точной оценке каменной массы[20]. Наконец, мы сосредоточились на потенциальном влиянии наличия предоперационного стента на пост-УС ССВО и рассмотрели причины стентирования. Предоперационный стент был значительно связан с пост-УС ССВО только при однофакторном анализе, но есть другие аргументы в пользу отрицательного воздействия предоперационного стентирования на риск развития инфекции после УС.
Выводы
Обструктивный пиелонефрит, предшествующий УС, положительный результат ПМП и женский пол были достоверно значимо связаны с пост-УС ССВО. Пациенты, у которых наблюдался обструктивный пиелонефрит, предшествующий УС, или имевшие положительный результат ПМП, подверглись повышенному риску развития пост-УС ССВО, несмотря на то, что они получали адекватную предоперационную антибактериальную терапию.
Список литературы
1. Giusti G, Proietti S, Peschechera R, Taverna G, Sortino G, Cindolo L, Graziotti P (2015) Sky is no limit for ureteroscopy: extending the indications and special circumstances. World J Urol 33:257–273
2. Cindolo L, Castellan P, Scoffone CM, Cracco CM, Celia A, Paccaduscio A, Schips L, Proietti S, Breda A, Guisti G (2016) Mortality and flexible ureteroscopy: analysis of six cases. World J Urol 34:305–310
3. Korets R, Graversen JA, Kates M, Mues AC, Gupta M (2011) Post-percutaneous nephrolithotomy systemic inflammatory response: a prospective analysis of preoperative urine, renal pelvic urine and stone cultures. J Urol 186:1899–1903
4. Draga RO, Kok ET, Sorel MR, Bosch RJ, Lock TM (2009) Percutaneous nephrolithotomy: factors associated with fever after the first postoperative day and systemic inflammatory response syndrome. J Endourol 23:921–927
5. Erdil T, Bostanci Y, Ozden E, Atac F, Yakupoglu YK, Yilmaz AF, Sarikaya S (2013) Risk factors for systemic inflammatory response syndrome following percutaneous nephrolithotomy. Urolithiasis 41:395–401
6. Blackmur JP, Maitra NU, Marri RR, Housami F, Malki M, Mcllhenny C (2016) Analysis of factors’ association with risk of postoperative urosepsis in patients undergoing ureteroscopy for treatment of stone disease. J Endourol 30:963–969
7. Fan S, Gong B, Hao Z, Zhang L, Zhou J, Zhang Y, Liang C (2015) Risk factors of infectious complications following flexible ureteroscope with a holmium laser: a retrospective study. Int J Clin Exp Med 8:11252–11259
8. Zhong W, Leto G, Wang L, Zeng G (2015) Systemic inflammatory response syndrome after flexible ureteroscopic lithotripsy: a study of risk factors. J Endourol 29:25–28
9. Bone RC, Balk RA, Cerra FB, Dellinger RP, Ferin AM, Knaus WA, Schein RM, Sibbald WJ (1992) Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest 101:1644–1655
10. Takazawa R, Kitayama S, Tsujii T (2015) Appropriate kidney stone size for ureteroscopic lithotripsy: when to switch to a percutaneous approach. World J Nephrol 4:111–117
11. Mokhmalji H, Braun PM, Martinez Portillo FJ, Siegsmund M, Alken P, Köhrmann KU (2001) Percutaneous nephrostomy versus ureteral stents for diversion of hydronephrosis caused by stones: a prospective, randomized clinical trial. J Urol 165:1088–1092
12. Kehinde EO, Rotimi VO, Al-Hunayan A, Abdul-Halim H, Boland F, Al-Awadi KA (2004) Bacteriology of urinary tract infection associated with indwelling J ureteral stents. J Endourol 18:891–896
13. Martov A, Gravas S, Etemadian M, Unsal A, Barusso G, D’Addessi A, Krambeck A, de la Rosette J, Clinical Research Office of the Endourological Society Ureteroscopy Study Group (2015) Postoperative infection rates in patients with a negative baseline urine culture undergoing ureteroscopic stone removal: a matched case-control analysis on antibiotic prophylaxis from the CROES УС global study. J Endourol 29:171–180
14. Kanno T, Matsuda A, Sakamoto H, Higashi Y, Yamada H (2013) Safety and efficacy of ureteroscopy after obstructive pyelonephritis treatment. Int J Urol 20:917–922
15. Youssef RF, Neisius A, Goldsmith ZG, Ghaffar M, Tsivian M, Shin RM, Cabrera F, Ferrandino MN, Scales CD, Preminger GM, Lipkin ME (2014) Clinical outcomes after ureteroscopic lithotripsy in patients who initially presented with urosepsis: matched pair comparison with elective ureteroscopy. J Endourol 28:1439–1443
16. Merigot de Treigny O, Bou Nasr E, Almont T, Tack I, Rischmann P, Soulié M, Huyghe E (2015) The cumulated stone diameter: a limited tool for stone burden estimation. Urology 86:477–481
17. Türk C, Petřík A, Sarica K, Seitz C, Skolarikos A, Straub M, Knoll T (2016) EAU guidelines on interventional treatment for urolithiasis. Eur Urol 69:475–482
18. Aboumarzouk OM, Monga M, Kata SG, Traxer O, Somani BK (2012) Flexible ureteroscopy and laser lithotripsy for stones > 2 cm: a systematic review and meta-analysis. J Endourol 26:1257–1263
19. Takazawa R, Kitayama S, Tsujii T (2012) Successful outcome of flexible ureteroscopy with holmium laser lithotripsy for renal stones 2 cm or greater. Int J Urol 19:264–267
20. Skolarikos A, Gross AJ, Krebs A, Unal D, Bercowsky E, Eltahawy E, Somani B, de la Rosette J (2015) Outcomes of flexible ureterorenoscopy for solitary renal stones in the CROES УС global study. J Urol 194:137–143
