Fengping Liu1,2*, Nan Zhang2*, Yunhong Wu2*, Peng Jiang2*, Tingting Jiang3, Yang Wang2, Yuwei Zhang2, Qixiao Zhai4*, Yeqing Zou5* and Ninghan Feng2*
Аннотация
Предпосылки исследования. Было опровергнуто давнее мнение о том, что в отсутствие инфекции моча в мочевом пузыре и кровь в кровотоке являются стерильными биожидкостями. Ранее не было сообщений о микробиоме мочи из почечной лоханки после санации мочевого пузыря у пациентов с почечнокаменной болезнью. Целью данного исследования было определить, присутствуют ли микроорганизмы в моче, находящейся в почечной лоханке, после устранения влияния микробиома мочи в мочевом пузыре, отличается ли качественный состав микробиома у пациентов с камнями в лоханке почки (КЛП) и с отсутствием камней в лоханке почки (ОКЛП), а также есть ли корреляция состава образцов мочи из КЛП с клиническими характеристиками пациента.
Результаты: Сравнение бактериального разнообразия и структуры штаммов микроорганизмов показало, что моча в мочевом пузыре была похожа на образцы мочи из КЛП и ОКЛП. Однако сравнения показали, что образцы мочи отличались от образцов крови. Наиболее типичные интраоперационные таксономические единицы были общими для всех трех типов образцов мочи. Количество Corynebacterium было достоверно выше в образцах КЛП по сравнению с ОКЛП. Некоторые бактерии были связаны с характеристиками пациентов, включая Lactobacillus, которые положительно коррелировали с уровнем глюкозы в крови натощак, и Prevotella, которые отрицательно коррелировали с ИМТ. Количество микроорганизмов рода Lactobacillus было достоверно выше в образцах КЛП по сравнению с кровью, но не в образцах ОКЛП по сравнению с кровью.
Выводы. Состав микробиома мочи почечной лоханки после дезинфекции мочевого пузыря и его сходство с микробиомом мочи мочевого пузыря указывают на то, что моча мочевого пузыря может использоваться в качестве аналога мочи почечной лоханки при исследованиях микробиома. Кроме того, сравнение КЛП и ОКЛП с клиническими ассоциациями позволяет предположить, что появление камней в почках влияет на микробиом мочи в почечной лоханке, содержащей камни.
Ключевые слова: микробиом мочевого пузыря, микробиом крови, микробиом мочи почечной лоханки, почечный камень, функция почек.
Авторы для переписки: zhaiqixiao@sina.com; zouyeqingyc63@163.com; n.feng@njmu.edu.cn
*Fengping Liu, Nan Zhang и Yunhong Wu внесли равный вклад в эту работу.
4 Ключевая государственная лаборатория пищевых наук и технологий и Школа пищевых наук и технологий, Университет Цзяннань, Уси 214122, Китай
5 Базовая медицинская школа, Медицинский колледж Цзянсу, Яньчэн 224000, Китай
2Отделение урологии дочерней больницы №2 Уси, Нанкинский медицинский университет, Уси 214002, Китай
Полный перечень информации об авторах доступен в конце статьи.
Предпосылки исследования
От почечнокаменной болезни в течение жизни страдает примерно каждый 11 человек, и распространенность заболевания все увеличивается [1]. Частота рецидивов в течение первых 5 лет после первоначального эпизода достигает 50% [2], а у некоторых пациентов может развиться хроническая болезнь почек и терминальная стадия почечной недостаточности [3]. Несмотря на высокую частоту возникновения и тяжелые осложнения, патофизиологические механизмы образования камней в почках остаются не полностью изученными. Предыдущие исследования показали, что возникновение камней в почках в основном связано с режимом питания [4]. Однако в последние десятилетия появляются новые данные, свидетельствующие о том, что дисбиоз кишечника связан с патофизиологией образования почечных камней [5–7]. Состав микробиома у пациентов с камнями почек демонстрирует более низкое биоразнообразие и отсутствие некоторых таксонов по сравнению с микробиомом, присутствующим у здоровых людей из контрольной группы [5]. Кроме того, эти изменения связаны с функциональными изменениями, способствующими развитию патологического процесса образования почечных камней [5].
Хотя раньше мочевой пузырь считался «стерильным», было показано, что моча в мочевом пузыре обладает собственным микробиомом [8, 9]. Микробиом кишечника влияет на здоровье кишечника человека; аналогично, микробиом мочевого пузыря также связан с заболеваниями мочевыводящих путей [10–12]. Недавно Dornbier и его коллеги сравнили мочу верхних и нижних отделов мочевыводящих путей у пациентов при мочекаменной болезни и получили информацию о составе микробиома верхних отделов тракта; авторы обнаружили, что не было значительных различий в спектре бактерий в моче верхних и нижних отделов [13].
Однако до сих пор неясно, присутствуют ли микроорганизмы в моче почечной лоханки после санации мочевого пузыря. Подобно ситуации с мочевым пузырем, догма о стерильности кровеносной системы человека также была опровергнута [14–16], а для микробного профиля крови была доказана связь с функцией почек [16]. Возникновение камней в почках связано с мутациями в генах, кодирующих плотные соединения эпителиальных клеток (например, клаудин-14, интегральный мембранный белок, обеспечивающий барьерную функцию), которые обеспечивают селективный межклеточный транспорт из системы кровообращения в почки [17]. Это может способствовать изменению состава мочи, повышению уровня кальция и оксалата в моче [18, 19], и снижению экскреции цитрата с мочой [20], что может повлиять на среду обитания микроорганизмов в почечной лоханке. Учитывая тесную анатомическую взаимосвязь между почечной лоханкой и мочевым пузырем, а также отличия в функции почек у пациентов с почечнокаменной болезнью, мы предполагаем, что микробиом мочи в почечной лоханке связан с микробиомом мочевого пузыря и микробиомом крови. Кроме того, мы предположили, что микробиом мочи в почечной лоханке различается в тех лоханках, в которых есть камни, и в тех, в которых камни отсутствуют, так как у камней, как сообщалось Dornbier с соавт., есть собственный микробиом [13]. Также мы предположили, что состав микробиома мочи в почечной лоханке влияет на клинические характеристики пациентов.
Результаты
Клинические параметры и комплексный количественный посев мочи (ККПМ)
Для исследования было отобрано 50 пациентов с односторонними камнями почек, у которых был отрицательный результат ККПМ при заборе мочи из мочевого пузыря после дезинфекции йодофором. Таблица 1 показывает, что процентное соотношение пациентов с повышенным уровнем мочевой кислоты в крови (МКК) и азота мочевины крови (АМК) составляло 24 и 20% соответственно. Доля пациентов со сниженной расчетной скоростью клубочковой фильтрации (РСКФ) составила 48%.
РСКФ выражается в мл/мин/1,73 м2.
Пациенты были разделены по РСКФ на пять групп:
1 стадия, РСКФ > 90;
2 стадия, РСКФ 60–89;
3 стадия, РСКФ 30–59;
4 стадия, РСКФ 15–29;
5 стадия, РСКФ < 15
Сокращения: МКК – Мочевая кислота крови, АМК – Азот мочевины крови, РСКФ – Расчетная скорость клубочковой фильтрации, СО – Среднеквадратичное отклонение
Кроме того, в таблице 1 показаны демографические данные пациентов, включая возраст, соотношение кальция и креатинина в моче, семейное положение и сопутствующие заболевания.
Характеристика на основе сиквенса
Всего было собрано 219 образцов, бактериальная ДНК была обнаружена в 47/50 образцах мочевого пузыря A (образцы мочи, забор которых проводили до дезинфекции мочевого пузыря), 44/50 образцах мочевого пузыря B (вновь образованная моча после дезинфекции мочевого пузыря), 48/50 образцах мочи из почечной лоханки, содержащей камень (камни) (КЛП; образцы КЛП использовались в нашем предыдущем исследовании для сравнения характеристик микробиома мочи пациентов с почечнокаменной болезнью на разных стадиях нарушения артериального давления и здоровых людей [21]), 17/19 образцах мочи из почечной лоханки, не содержащей камней (ОКЛП) и 32/50 пробах крови.
Эти образцы дали 11 067 154 сырых тегов (т.е. необработанных данных секвенирования), 10 767 904 действительных тега (т.е. считывания после фильтрации для удаления низкокачественных считываний, считываний с адаптерами и считываний с неизвестными базами) и 3232 ОТЕ. Охват Гуда, который считается относительной мерой того, насколько хорошо полученные последовательности представляют всю популяцию, составил 99,92%, что указывает на то, что секвенирование генома было выполнено на достаточной глубине для идентификации бактерий в образцах.
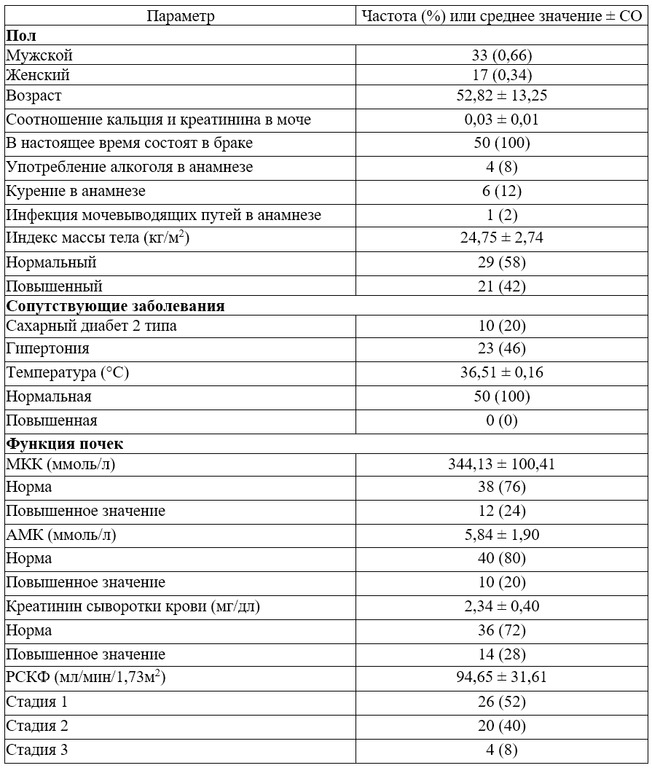
Для анализа спектра микробиома мочи в мочевом пузыре A, мочевом пузыре B, КЛП, ОКЛП и образцах крови были рассчитаны количество наблюдаемых видов и оценочная функция Chao1. Для оценки разнообразия были рассчитаны индексы Шеннона и Симпсона (Рис. 1а). Образцы мочи из мочевого пузыря A или мочевого пузыря B имели такие же значения микробного количества и разнообразия, что и почечная лоханка, включая КЛП и ОКЛП (q <0,05), то есть образцы мочи из мочевого пузыря и почечных лоханок имели почти равное количество уникальных и ожидаемых видов, уникальных видов и общего количества видов, а относительная численность этих видов была равной. Кроме того, образцы мочи имели более высокие значения индекса Шеннона, чем образцы крови (q <0,05), что указывает на то, что образцы мочи содержали более уникальные виды с более высоким относительным содержанием.
На основе перестановочного многомерного дисперсионного анализа и анализа главных координат (АГК) мы можем визуализировать сходство операционных таксономических единиц (ОТЕ) среди выборок. Статистически значимые различия в АГК наблюдались только между образцами мочи мочевого пузыря A/мочевого пузыря B/КЛП/ОКЛП и образцами крови (q <0,05; Рис. 1b).
Хотя количество общих ОТЕ составляло 34,76% от количества ОТЕ в образцах КЛП и мочевого пузыря A, а количество общих ОТЕ составляло 35,45% от количества ОТЕ в образцах КЛП и мочевого пузыря B (Рис. 1в), наиболее распространенные ОТЕ присутствовали во всех образцах мочи (Таблица S1). Кроме того, большое количество ОТЕ присутствовало только в одном образце из каждого типа мочи. Например, 543 ОТЕ присутствовали только в одном из образцов КЛП, включая ОТЕ 758, ОТЕ 526, ОТЕ 2058 и др.; кроме того, 819 ОТЕ определялись только один раз в одном из образцов мочевого пузыря A, включая ОТЕ 3824, ОТЕ 2888 и ОТЕ 3664.
Распределение бактерий и родов по группам
Роды бактерий с более чем 1% общей относительной численности показаны на Рис. 2. Относительная численность различных бактерий была следующей: Sphingomonas, Pontibacter и Bifidobacterium в группе мочевого пузыря A (7,01, 5,33 и 4,21%, соответственно), Bifidobacterium, Sphingomonas и Prevotella в группе мочевого пузыря B (6,44, 5,47 и 5,00% соответственно), Sphingomonas, Acinetobacter и Bifidobacterium в группе КЛП (8,67, 4,68 и 4,52% соответственно) и Acinetobacter, Sphingomonas и Delftia в группе ОКЛП (7,55, 7,19 и 4,01% соответственно). Тогда как в образцах крови преобладали Sphingomonas, Acinetobacter и Propionibacterium (16,56, 7,61 и 7,03% соответственно) (Рис. 2).
Было проведено сравнение основных родов бактерий, составляющих более 1% от общей численности в почечной лоханке, и в других образцах. Было установлено, что род Corynebacterium был представлен в большем количестве в образцах КЛП по сравнению с ОКЛП (q <0,05; Рис. 3а). Pseudomonas и Roseburia достоверно различались между образцами мочевого пузыря A и ОКЛП (q <0,05; Рис. 4а). Интересно, что почти все роды бактерий, показавшие значимые различия между ОКЛП и образцами крови, показали аналогичные различия между КЛП и образцами крови, за исключением Pseudomonas. Численность Lactobacillus была значительно выше в образцах КЛП, чем в образцах крови (q <0,05; Рис. 3b и Рис. 4b).
Выделение бактерий с помощью ККПМ и их идентификация методом секвенирования 16S рРНК
Было установлено, что некоторые бактерии в микробном сообществе, которые культивировались с помощью ККПМ, могли быть также секвенированы с помощью метода 16S рРНК. Например, Acetobacteraceae, Acidovorax, Aerococcus, Agrococcus, Arthrobacter, Brevibacterium, Brevundimonas, Clostridium, Curtobacterium, Elizabethkingia, Herbaspirillum, Janthinobacterium, Jeotgalicoccus, Kocuria, Lactococcus, Memnoniella, Microbacterium, Moraxella, Myrmecridium, Nigrospora, Paenibacillus, Paenisporosarcina, Pseudoclavibacter, Pseudomonas, Psychrobacter, Rhodococcus, Roseomonas, Saccharopolyspora, Sphingomonas и Staphylococcus в микробном сообществе были обнаружены с помощью как ККПМ, так и методом секвенирования 16S рРНК. Однако некоторые бактерии микробного сообщества, выделенные с помощью ККПМ, не удалось секвенировать. Например, из большинства образцов выделяли Bacillus spp., в то время как обнаружить их с помощью секвенирования 16S не удалось (Таблица S2).
Связь микробиома мочи в образцах КЛП с характеристиками пациентов
Был проведен корреляционный анализ Пирсона, и мы обнаружили, что основные роды бактерий не коррелировали с возрастом пациентов или значениями АМК и РСКФ. Интересно, что анализ АГК показал, что не было значимой разницы между мужчинами и женщинами как в образцах мочевого пузыря А, так и КЛП (q> 0,05; Рис. S1 A и S1 C) или в образцах из мочевого пузыря А и КЛП между женщинами в предменструальный и постменструальный период (q> 0,05; Рисунок S1 B и S1 D).
Было определено 15 наиболее распространенных родов бактерий в подгруппах мужчин и женщин, а также в образцах мочевого пузыря А и КЛП женщин в предменструальный и постменструальный периоды. Как показано на рисунке S2A, Sphingomonas, Bifidobacterium, Acinetobacter, Pontibacter и Delftia доминировали в образцах мочи мочевого пузыря A у мужчин (6,89, 5,08, 4,66, 4,09 и 3,75% соответственно), тогда как Staphylococcus, Pontibacter, Sphingomonas, Prevoteacterium преобладали в образцах мочевого пузыря А у женщин (7,75, 7,72, 7,24, 5,84 и 5,66% соответственно).
В образцах мочи мочевого пузыря A у женщин в предменструальный период преобладали Pontibacter, Streptococcus, Sphingomonas, Propionibacterium и Bifidobacterium (15,36, 11,27, 7,49, 6,59 и 3,32% соответственно); в образцах, отобранных в постменструальный период, преобладали Staphylococcus, Prevotella, Sphingomonas, Roseburia и Propionibacterium (11,26, 8,22, 7,10, 5,57 и 5,39% соответственно; Рисунок S2 B). Кроме того, не было значительных различий между образцами мочи мочевого пузыря А мужчин и женщин или между женщинами в предменструальный и постменструальный периоды (q> 0,05).
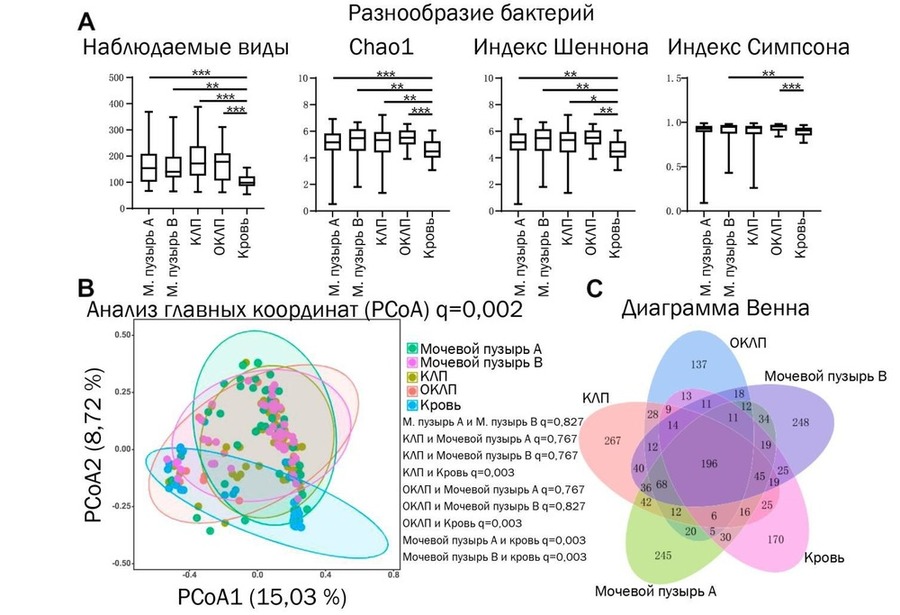
Рис. 1. Бактериальное разнообразие и структура среди групп. А Сравнение альфа-разнообразия (наблюдаемые виды, Chao1, индекс Шеннона и индекс Симпсона) между микробиомом мочи мочевого пузыря A, мочевого пузыря B, КЛП, ОКЛП и образцов крови показывает более низкую бактериальную обсемененность и разнообразие в образцах крови, чем в других группах. B Анализ главных координат (PCoA) показывает кластеризацию бактериального состава образцов мочевого пузыря A, мочевого пузыря B, КЛП, ОКЛП и крови на основе расстояний Брея-Кертиса, причем каждая точка соответствует пациенту и окрашена в соответствии с типом образца (мочевой пузырь A, мочевой пузырь B, КЛП, ОКЛП или кровь). Перестановочный многомерный дисперсионный анализ (PERMANOVA) указал, что бактериальные сообщества между КЛП и мочевым пузырем A / мочевым пузырем B / ОКЛП существенно не различались (p> 0,05), тогда как КЛП и кровь значительно различались (p = 0,003); Мочевой пузырь A / мочевой пузырь B по сравнению с ОКЛП не имели значимых различий (p> 0,05), тогда как ОКЛП по сравнению с кровью существенно различались (p = 0,003); Между мочевым пузырем A и мочевым пузырем B не было значимых различий (p> 0,05), тогда как разница между мочевым пузырем A и кровью была значимой (0,003); Мочевой пузырь B и кровь значительно различались (p = 0,003). C Диаграмма Венна показывает, что количество общих ОТЕ для образцов мочи почечных лоханок (включая КЛП и ОКЛП) и образцов крови ниже, чем общих ОТЕ для образцов мочевого пузыря A / B и образцов мочи почечных лоханок. Кроме того, количество общих ОТЕ для образцов мочевого пузыря A / B и КЛП ниже, чем количество общих ОТЕ для образцов мочевого пузыря A / B и ОКЛП.
Сокращения: ОКЛП – образцы мочи из почечной лоханки, не содержащей камней; ОТЕ – операционные таксономические единицы; PCoA – анализ главных координат; PERMANOVA – перестановочный многомерный дисперсионный анализ; КЛП – образцы мочи из почечной лоханки, содержащей камень (камни).
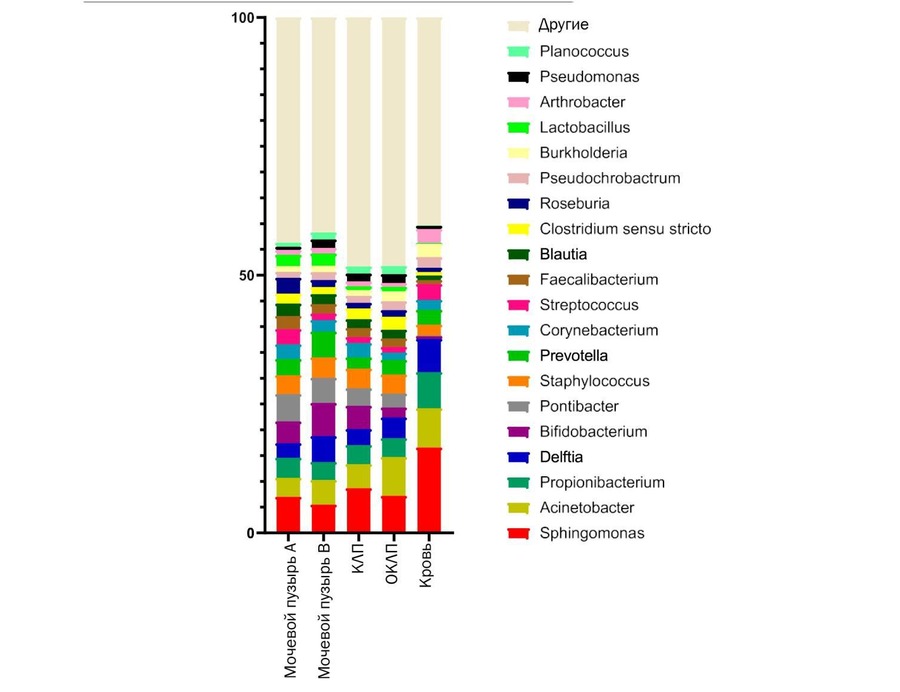
Рис. 2. Распределение родов бактерий по группам. Относительное содержание основных родов бактерий, определенное методом секвенирования гена 16S рДНК. Образцы КЛП и ОКЛП были более схожими с образцами из мочевого пузыря А, чем с образцами крови. «Другие» включает все остальные обнаруженные бактерии. Сокращения: ОКЛП – образцы мочи из почечной лоханки, не содержащей камней; КЛП – образцы мочи из почечной лоханки, содержащей камень (камни)
В образцах мочи КЛП мужчин преобладали Sphingomonas (8,52%), Bifidobacterium (5,30%), Acinetobacter (4,83%), Propionibacterium (3,28%) и Delftia (3,16%) (Рисунок S2 C), в то время как в образцах женщин преобладали Sphingomonas (8,95%), Staphylococcus (8,25%), Pontibacter (4,89%), Propionibacterium (4,42%) и Acinetobacter (4,40%) и т.д.
Когда образцы КЛП женщин были разделены на предменструальные и постменструальные подгруппы, в образцах женщин в предменструальный период преобладали Staphylococcus, Pontibacter, Sphingomonas, Faecalibacterium и Bacteroides (13,85, 12,36, 6,54, 5,34 и 4,19% соответственно), тогда как в образцах женщин в постменструальный период преобладали Sphingomonas, Acinetobacter, Staphylococcus, Propionibacterium и Delftia (10,26, 6,33, 5,20, 4,71 и 4,68% соответственно, Рисунок S2 D). Было проведено сравнение 15 наиболее распространенных родов бактерий между подгруппами мужчин и женщин, а также между женщинами в предменструальный и постменструальный периоды, значимых различий выявлено не было (q> 0,05).
Примечательно, что несколько родов бактерий имели ассоциации с характеристиками пациентов. Например, Lactobacillus положительно коррелировали с уровнем глюкозы в крови натощак (r = 0,333, p = 0,021), Arthrobacter положительно коррелировали с индексом массы тела (r = 0,551, p <0,001), Prevotella отрицательно коррелировали с индексом массы тела (r = - 0,369, p = 0,010).
Обсуждение
Старая догма о том, что моча в здоровом мочевом пузыре стерильна, была разрушена благодаря применению технологии секвенирования 16S рРНК и метода ККПМ [22–24]. Роль микробиома мочевого пузыря в развитии заболеваний мочевыводящих путей была изучена недавно при использовании образцов мочи, полученных при помощи катетера [11, 22, 24, 25]. Точно так же растет число исследований, изучающих концепцию, что наличие бактерий в крови человека не обязательно приравнивается к наличию инфекции [15, 16, 26, 27]. В настоящем исследовании было доказано существование микробиома мочи в почечной лоханке и его связь с микробиомом мочевого пузыря и крови у пациентов с камнями в почках. Также было проведено сравнение состава микробиома почечной лоханки с камнями и без них. Впервые была применена повторная дезинфекция мочевого пузыря при цистоскопии, чтобы исключить влияние микроорганизмов в мочевом пузыре. За этим последовало использование ККПМ – методики культивирования живых бактерий из мочи [23] для проверки эффективности дезинфекции. Важно отметить, что мы пришли к выводу, что, хотя на состав микробиома мочи в КЛП влияли клинические параметры пациентов, влияющие факторы не похожи на факторы, влияющие на микробиом кишечника
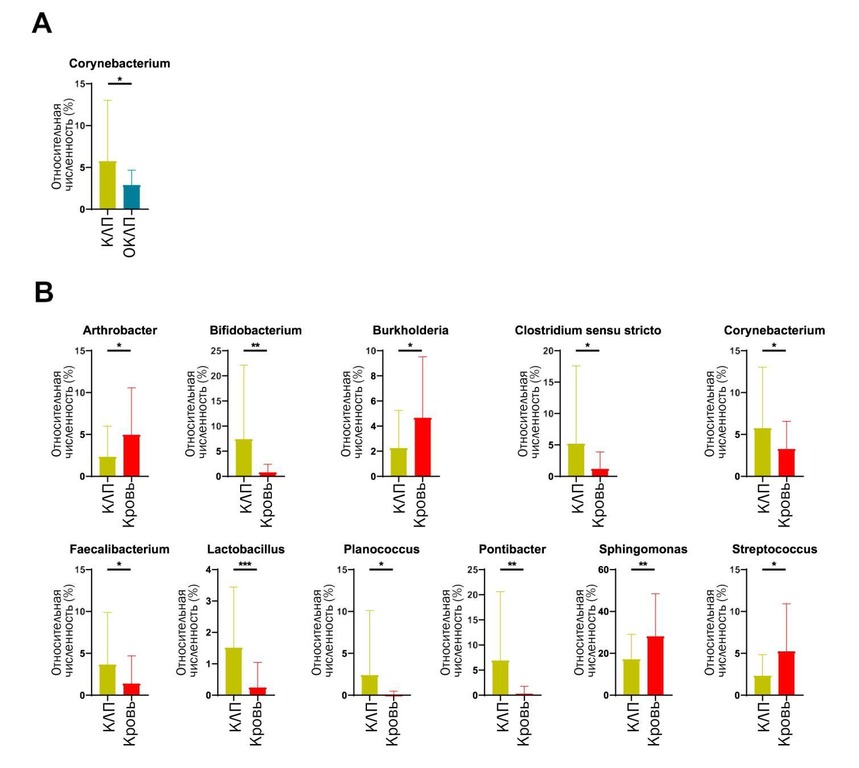
Рис. 3 Численность бактерий, показывающая значительную разницу между КЛП и другими образцами. Непараметрический t-критерий Уайта использовался для сравнения разницы в численности между двумя группами. *, **, *** означает p <0,05, p <0,01, p <0,001 соответственно. Сокращения: ОКЛП – отсутствие камней в лоханке почки; КЛП – камни в лоханке почки
Количество образцов мочевого пузыря A, мочевого пузыря B, КЛП и ОКЛП с положительным результатом секвенирования было одинаковым; однако это число было ниже для образцов крови. В соответствии с результатами секвенирования сравнение альфа-разнообразия показало, что для образцов крови было характерно самое низкое бактериальное разнообразие по сравнению с образцами мочи из почечной лоханки или мочевого пузыря. Эти данные свидетельствуют о том, что бактериальная биомасса в крови ниже, чем в моче пациентов с камнями в почках. Это может быть связано с недостаточностью функции почек, отмеченной примерно у половины пациентов. Недавнее исследование показало, что у пациентов с хроническим заболеванием почек уменьшается разнообразие бактерий в крови [16].
Как АГК, так и диаграмма Венна продемонстрировали, что состав микробиома в моче почечной лоханки был аналогичен таковому в моче мочевого пузыря. Сходство микробиома мочи в почечной лоханке и мочевом пузыре согласуется с выводами Dornbier с соавт., в исследованиях которых микробиомы мочи в верхних мочевых путях и мочевом пузыре пациентов с камнями в почках были сходными [13]. В настоящем исследовании исходная моча из мочевого пузыря была удалена с последующей повторной обработкой мочевого пузыря йодофором и промыванием физиологическим раствором. Однако Dornbier с соавт. не дезинфицировали мочевой пузырь перед забором мочи из почечной лоханки. Таким образом, результаты их и нашего исследования показывают, что дезинфекция мочевого пузыря может не потребоваться для сбора образцов мочи из почечной лоханки или что мочу из мочевого пузыря можно использовать в исследованиях, описывающих характеристики мочи из почечной лоханки.
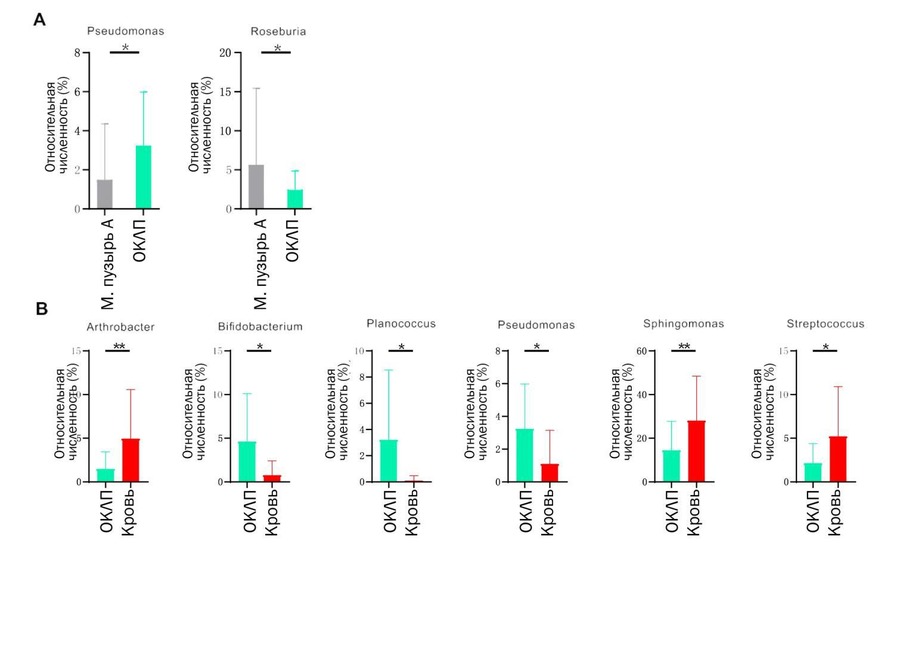
Рис. 4 Численность бактерий, показывающая значительную разницу между ОКЛП и другими образцами. Непараметрический t-критерий Уайта использовался для сравнения разницы в численности между двумя группами. *, **, *** означает p <0,05, p <0,01, p <0,001 соответственно. Сокращения: ОКЛП – Отсутствие камней в лоханке почки.
Некоторые роды бактерий в мочевом пузыре и почечной лоханке, включая Acinetobacter, Bifidobacterium, Corynebacterium, Lactobacillus, Staphylococcus и Streptococcus, ранее также выявлялись и были доминирующими у пациентов с почечнокаменной болезнью [13, 28]. Хотя основные бактерии в настоящем исследовании, включая Delftia, Propionibacterium и Sphingomonas, не были описаны в предыдущем исследовании микробиома мочи у пациентов с почечнокаменной болезнью, было продемонстрировано, что их присутствие в микробиоме мочи коррелирует с различными физиологическими состояниями человека. Например, бактерии рода Delftia были представлены в моче пациентов с сахарным диабетом 2 типа в больших количествах [29], Propionibacterium часто высевались из мочи пациентов с бактериальным вагинозом [10], а Sphingomonas, как правило, были более многочисленными у пациентов, перенесших трансплантацию почки и находящихся в стабильном состоянии [30]. Необходимо провести дополнительные исследования для изучения роли этих бактерий в микробиоме мочи человека.
Большинство основных родов бактерий в образцах КЛП и ОКЛП были похожи. Однако количество Corynebacterium было значительно выше в группе КЛП по сравнению с группой ОКЛП. Предыдущие исследования подтвердили, что наличие Corynebacterium spp. связано с камнеобразованием [31, 32]. Точно так же Corynebacterium считались основным родом бактерий в двух образцах в публикации Dornbier с соавт. о микробиоме камней в почках человека [13]. Таким образом, повышенный уровень Corynebacterium может быть защитной реакцией в КЛП у пациентов с камнями в почках.
Мы обнаружили, что не было значительных различий в основных родах бактерий между образцами мочевого пузыря А и КЛП, в то время как численность Pseudomonas и Roseburia была значительно выше или ниже в ОКЛП по сравнению с мочевым пузырем А, соответственно. Эти данные могут быть связаны с тем, что пузырно-мочеточниковый рефлюкс часто встречается у пациентов с почечнокаменной болезнью [33], т.е. увеличивается вероятность оттока мочи из мочевого пузыря в лоханку почек, что может привести к повышению общего уровня микроорганизмов между КЛП и мочевым пузырем.
При сравнении микробиомов в почечной лоханке и крови мы обнаружили, что количество основных родов бактерий, показывающих значимые различия между КЛП и образцами крови, было больше, чем между ОКЛП и образцами крови. Эти данные косвенно предполагают, что появление камней в почках повлияло на микробиом мочи в почечной лоханке.
Стоит отметить, что количество Lactobacillus было значительно выше в образцах КЛП по сравнению с кровью, но не в образцах ОКЛП по сравнению с кровью. Это открытие указывает на то, что появление камней в почках может активировать защитный механизм микробиома мочи лоханки почек, поскольку Lactobacillus являются пробиотическими микроорганизмами, которые способны предотвращать образование камней в почках из-за своей способности по разложению оксалатов [34].
Мы обнаружили, что результаты ККПМ для некоторых образцов не соответствовали результатам таксономии (определение рода бактерий) в моче мочевого пузыря. Аналогичные результаты были получены Dornbier RA с соавт.; например, одна проба мочи, полученная от пациента женского пола, содержала Ochrobactrum spp. на основе ККПМ, но при использовании метода секвенирования преобладали Corynebacterium и Enterobacteriaceae [13]. Эти результаты показывают, что исследователям и клиницистам полезно получить полное представление о микробиоме мочи при использовании как метода секвенирования 16S рРНК, так и при помощи ККПМ.
Хотя данное исследование не показало, что пол, возраст или менструальный статус пациенток коррелировали с видовым составом микробиоты в мочевом пузыре и КЛП при текущем размере выборки, что отличается от аналогичных корреляций, показанных для микробиома кишечника, мы обнаружили, что несколько основных видов бактерий коррелировали с клиническими параметрами пациентов. Например, количество Lactobacillus увеличивалось с увеличением уровня глюкозы в крови натощак, что аналогично предыдущему исследованию микробиома мочи, проведенному Chen JW с соавт. В том исследовании группа Lactobacillus была чрезмерно представлена в группе A1c с высоким уровнем гемоглобина [29]. Кроме того, мы обнаружили, что высокое содержание Prevotella связано с низким ИМТ. Трудно определить роль Prevotella для здоровья человека, поскольку недавнее исследование показало, что корреляция между Prevotella и ИМТ в предыдущих исследованиях на людях не была последовательной [35].
Выводы
Это исследование доказало существование микробиома мочи в почечной лоханке после дезинфекции мочевого пузыря, а микробиом мочи в почечной лоханке был аналогичен таковому в моче мочевого пузыря, но микробиомы мочи мочевого пузыря и мочи почечной лоханки были не похожи на микробиом крови. В некоторой степени мы установили, что микробиом мочи в образцах КЛП отличался от такового в образцах ОКЛП, что связано с изменением содержания Corynebacterium в образцах КЛП. Хотя механизм, ответственный за этот процесс, остается неясным, результаты показывают, что на процесс образования камней в почках можно воздействовать путем влияния на количество Corynebacterium, например, за счет диетотерапии. Кроме того, мы обнаружили, что бактериальный профиль образцов КЛП был связан с клиническими характеристиками пациентов, что указывает на то, что изменение этих характеристик, включая уровень глюкозы в крови натощак и ИМТ, с помощью терапии на основе воздействия на микробиом, может играть роль в процессе контроля над возникновением камней в почках. Стоит отметить, что настоящее исследование продемонстрировало наличие бактерий в мочевом пузыре и почечной лоханке, а также в крови. Дальнейшие исследования должны охарактеризовать последовательность изменений, которые могут предоставить стратегии целостной терапии для поддержания баланса микробиома.
Ограничение этого исследования состоит в том, что размер выборки был недостаточным, что снизило статистическую мощность обнаружения истинных различий между группами образцов. Более того, хотя мочевой пузырь неоднократно дезинфицировался перед сбором мочи из почечной лоханки, это не может полностью предотвратить загрязнение мочи почечной лоханки мочой мочевого пузыря. Когда цистоскоп и катетер проходили через уретру и мочевой пузырь в почечную лоханку для сбора образцов мочи, бактериальная колонизация уротелия могла привести к загрязнению инструментов и образцов [36].
Поэтому в будущем необходимо будет собирать образцы с помощью чрескожной пункции почек, чтобы гарантировать, что моча почечной лоханки не загрязнена мочой мочевого пузыря. В-третьих, мы исключили пациентов с отрицательными результатами посева мочи из мочевого пузыря А, однако бактерии могли присутствовать в моче почечной лоханки этих пациентов. Это избирательная ошибка, которую можно не допустить, используя чрескожную пункцию почек для сбора лоханочной мочи в будущем. В-четвертых, отсутствие образцов мочи почечной лоханки людей без мочекаменной болезни для сравнения микробиома мочи у пациентов с мочекаменной болезнью и без нее, является одним из ограничений настоящего исследования. Наконец, результаты ПЦР только из 9 образцов были случайным образом выбраны для двукратного секвенирования из-за ограниченной финансовой поддержки нашего проекта, что может исказить результаты настоящего исследования.
Методы
Отбор пациентов и размер выборки
Протокол исследования был одобрен Комитетом по этической экспертизе Второй больницы Уси, Нанкинского медицинского университета (№ 201802), все пациенты предоставили письменное информированное согласие на использование своих образцов. Процесс соответствовал Хельсинкской декларации, которая предполагает оценку риска и пользы. Наличие кальциевых камней в почках было подтверждено рентгенологическим исследованием брюшной полости, ультрасонографией и компьютерной томографией. Пациенты, перенесшие уретероскопическую литотрипсию, отбирались в период с октября 2018 г. по апрель 2019 г. Применялись следующие критерии исключения: менструация или беременность, рак, аутоиммунное заболевание, заболевание мочевыводящих путей (включая уретрит, простатит, доброкачественную гиперплазию предстательной железы, кисту почек и цистит), деформация мочевыводящих путей, подозрение на инфекцию мочевыводящих путей на основании клинической оценки, катетеризация мочевыводящих путей в предыдущие 4 недели и лечение антибиотиками в предыдущие 4 недели. Основываясь на предыдущих исследованиях, в которых сравнивали микробиомы в разных полостях тела [37, 38], было установлено, что 50 участников исследования достаточно, чтобы определить различия в их микробиомах.
Забор образцов
Шесть хирургов с опытом проведения уретероскопической литотрипсии ≥10 лет были обучены методам дезинфекции и забора образцов мочи; это дало гарантию, что хирурги использовали единый метод дезинфекции уретры и окружающих ее тканей и мочевого пузыря. Кроме того, от них требовалось использовать унифицированные методы для введения уретероскопа и катетера в почечную лоханку. В частности, после введения пациенту общей анестезии были использованы следующие процедуры для сбора образцов: (а) Дезинфекция области промежности и мочевого прохода йодофором не менее трех раз. (b) Введение уретероскопа (Ричард Вольф, Киниттлиген, Германия) и извлечение 3 мл мочи из мочевого пузыря (образец обозначали как «Мочевой пузырь А»). Методика ККПМ использовалась для обнаружения живых бактерий (> 10 колониеобразующих единиц на мл) в моче из мочевого пузыря [23]. Пациенты с отрицательными результатами посева были исключены из исследования, поскольку предыдущие исследования с использованием ККПМ показали наличие живых бактерий в мочевом пузыре человека [22, 39]. (c) Остаточная моча удалялась из мочевого пузыря. Мочевой пузырь дезинфицировали йодофором три раза, уретероскоп использовали для проверки, полностью ли мочевой пузырь заполнен йодофором. Перед аспирацией йодофор сохранялся в мочевом пузыре в течение ≥30 с. Впоследствии проводили аспирацию 3 мл йодофора из последнего лаважа, а также снова была применена методика ККПМ для проверки наличия бактерий в новообразованной моче после дезинфекции [22].
Если бактерии в мочевом пузыре не были полностью уничтожены, они могли загрязнить образцы мочи в почечной лоханке, поскольку образцы мочи из почечной лоханки собирались с помощью цистоскопии через мочевой пузырь. Таким образом, пациенты с положительными результатами посева после дезинфекции мочевого пузыря были исключены из исследования. (d) Стерильный физиологический раствор использовался для трехкратного промывания мочевого пузыря и стимулирования выведения йодофора. Катетер 6–7F (Компания New District Hua-Sheng Medical Instrument, Сучжоу, Китай) помещали в уретероскоп, и всю конструкцию осторожно вставляли в лоханку почки с камнем (камнями).
Мочу (3 мл) отбирали из почечной лоханки, образцы помечались как «КЛП» (моча из почечной лоханки, содержащей камень (камни)). Уретероскоп и катетер вынимались. (e) Затем повторяли процедуру (c). Далее использовали новый уретероскоп, в который вставляли новую трубку 6–7F. Тем же пациентам уретероскоп с трубкой вставляли в другую почечную лоханку, которая не содержала камней, мочу (3 мл) аспирировали из этой почечной лоханки и помечали образец как «ОКЛП» (моча из лоханки, не содержащей камни). Образцы ОКЛП не собирались у пациентов, у которых мочеточник был слишком узким для введения уретероскопа. (f) Новообразованную в мочевом пузыре мочу (3 мл) собирали и обозначали образец как «Мочевой пузырь B».
Посев мочи
Процедура ККПМ заключалась в следующем: 0,1 мл мочи вносили на 5% агар с овечьей кровью (КА), «шоколадный» агар, агар с колистином и налидиксовой кислотой (КНКА), выполняли посев штрихом для количественного определения и инкубировали в 5% СО2 при 35 °C в течение 48 ч. Для второго посева использовали чашки с КА, на которые вносили 0,1 мл мочи и инкубировали в обычной атмосфере при 35 °C и 30 °C в течение 48 часов. Затем 0,1 мл мочи вносили на чашки с КНКА и 5% агаром с овечьей кровью и инкубировали в газовой смеси Кэмпи (5% O2, 10% CO2, 85% N) при 35 °C в течение 48 часов.
Уровень обнаружения составлял 10 КОЕ/мл, что было представлено 1 колонией на любой из чашек. Наконец, для обнаружения любых видов бактерий, которые могут присутствовать в количествах ниже 10 КОЕ/мл, 1,0 мл мочи помещали в тиогликолевую среду (жидкая накопительная среда в пробирках) и инкубировали в аэробных условиях при 35 °C в течение 5 дней. Если наблюдался рост микроорганизмов на тиогликолевой среде, среду в пробирке перемешивали и несколько капель наносили на чашки с КА и КНКА для выделения микроорганизмов и инкубировали в аэробных и анаэробных условиях при 35 °C в течение 48 часов. Все чашки Петри и среды, использованные в настоящем исследовании, были изготовлены компанией Comagal Microbial Technology Co., Ltd., Китай.
Все процедуры ККПМ, изоляции бактерий и выделения геномной ДНК проводились в боксах с биозащитой, которые заранее стерилизовали дезинфицирующим средством с хлором, спиртовым раствором и ультрафиолетом. ПЦР для амплификации гена 16S рРНК проводили с использованием универсальных праймеров; 27F использовали в качестве прямого праймера и 1492 в качестве обратного праймера. Полосу ПЦР от каждого изолята секвенировали по Сэнгеру, микроорганизмы идентифицировали до уровня штамма с помощью BLAST. Если последовательность генома бактерии трижды была идентифицирована как гетерозиготная или с трудом связывалась, бактерия определялась как неидентифицированный изолят. Уровень сходства для определения бактериальной последовательности составляла 97% [40]. Когда сходство превышало 97% для нескольких бактерий, отображался только один вариант с наибольшим сходством.
Опытная медсестра собирала все образцы крови следующим образом: (а) кожа в месте внутривенной инъекции была продезинфицирована йодофором; (b) В вену вводили иглу и брали кровь (5 мл); (c) Пробка вакуумной пробирки, содержащей этилендиаминтетрауксусную кислоту (ЭДТА), удалялась, в нее осторожно вводилась кровь, а затем пробирка снова закрывалась пробкой.
Обработка образцов и секвенирование
Образцы мочевого пузыря А, мочевого пузыря В, КЛП и ОКЛП немедленно в операционной помещались в пенопластовый держатель с пакетами льда, а затем немедленно транспортировались в лабораторию нашей больницы в течение 10 минут. Всего 1 мл мочи центрифугировали при 20000 × g в течение 30 мин, и полученный осадок ресуспендировали в 150 мкл буфера для лизиса (BGI Inc., Шэньчжэнь, Китай). Как описано в нашем предыдущем исследовании, магнитные частицы, модифицированные карбоксилатом Sera-Mag ™ SpeedBeads (Компания GE Healthcare UK, Бакингемшир, Великобритания), были использованы для извлечения ДНК в соответствии с инструкциями, предоставленными производителем [21]. Образцы лейкоцитов из некоагулированной крови использовались для выделения бактериальной ДНК из крови [16], применялся тот же метод, который использовался для образцов мочи. Концентрацию ДНК определяли с помощью флуориметра Qubit.
Бактериальную ДНК амплифицировали с помощью полимеразной цепной реакции с 35 циклами с использованием универсальных праймеров 341F и 806R [41, 42], которые нацелены на вариабельные области V3-V4 гена 16S рРНК. Ампликоны анализировали с помощью гель-электрофореза и очищали с использованием набора для экстракции гелей QIAquick (QIAGEN, Hilden, Германия). Продукты разбавляли до концентрации 10 нг/мкл, брали 5 мкл каждого образца для секвенирования PE300 с использованием системы HiSeq 2500 (Illumina Inc., Сан-Диего, Калифорния, США). Отрицательные контроли экстракции ДНК содержали физиологический раствор вместо мочи или крови, они были добавлены для оценки вероятности попадания посторонней ДНК из реагентов. Кроме того, для секвенирования добавляли отрицательные контроли без ДНК-матрицы (т.е. без продукта ПЦР).
Биоинформатический анализ
Считывание парных концов присваивалось образцам на основе их уникального штрих-кода и обрезалось путем отсечения штрих-кода и последовательности праймера. Чтения на парном конце обьединялись с помощью FLASH. Качественная фильтрация необработанных тегов выполнялась при определенных условиях фильтрации для получения высококачественных чистых тегов в соответствии с fqtrim v0.94. Химерные последовательности были отфильтрованы, а последовательности, которые обладали сходством ≥97% были отнесены к одному и тому же ОТЕ с помощью Vsearch v2.3.4. Репрезентативные последовательности были выбраны для каждой ОТЕ, а затем таксономические данные присваивались каждой репрезентативной последовательности с использованием Ribosomal Database Project (RDP) 11.5, выпущенной 30 сентября 2016 года, со значением достоверности 0,8 в качестве порогового значения.
Последовательности использовались в качестве запросов для поиска в базе данных нуклеотидов Национального центра биотехнологической информации (NCBI) (загружена в апреле 2019 года). Были удалены образцы с <30 000 чистых тегов. Загрязняющие последовательности (на основе отрицательных контролей) были удалены с помощью Decontam v1.2.1 и порогового значения p <0,1 [43, 44].
Данные о численности ОТЕ были нормализованы с использованием стандартного порядкового номера, соответствующего образцу с наименьшим количеством последовательностей. Альфа-разнообразие применялось для анализа сложности видового разнообразия в каждой выборке с использованием QIIME v1.8.0 для расчета индекса альфа-разнообразия, включая наблюдаемые виды, Chao1, индекс Шеннона и индекс Симпсона [45]. Наблюдаемые виды – это количество уникальных видов, встречающихся в выборке или сообществе. Chao 1 – это измерение видов, ожидаемых в образцах, с учетом всех видов бактерий, идентифицированных в образцах [46]. Индекс Шеннона – это количество уникальных видов и их относительная численность в выборке. Индекс Симпсона оценивает относительную численность всех видов в сообществе [45].
Анализ бета-разнообразия был использован для оценки различий в кластеризации видов между разными типами выборок [47]. Для выявления сходства между КЛП, ОКЛП, мочевым пузырем A, мочевым пузырем B и образцами крови, образцы сравнивали с использованием АГК с несходством Брея-Кертиса на уровне ОТЕ (R package vegan) [47]. Перестановочный многомерный дисперсионный анализ применялся, чтобы определить, были ли различия в бактериальных сообществах разных групп значительными. На основе обилия ОТЕ была использована диаграмма Венна для отображения количества микробных ОТЕ, общих для пяти групп образцов. Характеристики пациентов были собраны путем изучения медицинских карт.
Показатели функции почек
Показатели функции почек измерялись на приборе Olympus AU5421–04 (Beckman Olympus, США) в клинической лаборатории нашей больницы. Нормальный диапазон уровня азота мочевины крови (АМК) был определен как 2,5–7,1 ммоль/л, а уровень мочевой кислоты крови (МКК) составлял 200–430 ммоль/л у мужчин и 140–360 ммоль/л у женщин. РСКФ выражали в мл/мин/1,73 м2. Пациенты были разделены на пять групп по исходному уровню РСКФ: 1 стадия, РСКФ> 90; 2 стадия, РСКФ 60–89; 3 стадия, РСКФ 30–59; 4 стадия, РСКФ 15–29; и 5 стадия, РСКФ <15.
Статистический анализ Данные не имели нормального распределения. Так, для попарного сравнения бактериальных сообществ использовали непараметрический t-критерий Уайта [48]. Для групповых сравнений альфа-индексов использовался знаковый ранговый критерий Вилкоксона. Кроме того, корреляция родов бактерий в образцах КЛП и характеристик пациентов была проанализирована с помощью корреляционного анализа Пирсона. Все значения P были скорректированы с использованием поправки на частоту ложных открытий Бенджамина-Хохберга, значения q < 0,05 считались статистически значимыми [48].
Аббревиатуры
КЛП: Камни лоханки почки;
МКК: Мочевая кислота крови;
РСКФ: Расчетная скорость клубочковой фильтрации;
ККПМ: Комплексный количественный посев мочи;
ОКЛП: Отсутствие камней лоханки почки;
ОТЕ: Оперативные таксономические единицы;
АГК: Анализ главных координат;
АМК: Азот мочевины крови
Благодарности
Мы благодарим добровольцев, принявших участие в нашем исследовании, и хирургов, проводивших забор образцов.
Вклад авторов
N F, Q Z, Y Z и F L разработали дизайн исследования. Y W, Y W, P J, N F и N Z собрали образцы и данные пациентов. F L, P J и N Z проводили культивирование мочи и выделение бактериальной ДНК. F L, T J и Y Z сгенерировали и проанализировали данные секвенирования, провели вычислительный анализ и интерпретировали результаты, а F L, N F и Q Z составили черновик рукописи. Все авторы прочитали и утвердили окончательную версию рукописи.
Финансирование
Это исследование было профинансировано в рамках Специального проекта группы медицинских инноваций в провинции Цзянсу (номер гранта: CXTDA2017047). Финансирующие организации не имели никакого влияния на дизайн исследования, сбор и интерпретацию данных и не участвовали в принятии решения о представлении работы для публикации.
Доступность данных и материалов
Данные секвенирования из этого исследования были задепонированы в архиве последовательностей GenBank под номером доступа SRP218817 (https://www. ncbi.nlm.nih.gov/bioproject/PRJNA561017/).
Соблюдение этических норм и согласие на участие
Протокол исследования был одобрен Комитетом по этической экспертизе Второй больницы Уси, Нанкинского медицинского университета (№ 201802), все пациенты предоставили письменное информированное согласие на использование своих образцов.
Согласие на публикацию
Не применимо
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов
Информация об авторах
1Медицинская школа Уси, Университет Цзяннань, Уси 214122, Китай.
2Отделение урологии Аффилированной больницы №2 г. Уси, Нанкинский медицинский университет, Уси 214002, Китай.
3Компания LC-Bio Technology Co, Ltd, Ханчжоу 310000, Китай.
4Ключевая государственная лаборатория пищевых наук и технологий и Школа пищевых наук и технологий, Университет Цзяннань, Уси 214122, Китай.
5Базовая медицинская школа, Медицинский колледж Цзянсу, Яньчэн 224000, Китай.
Статья получена 9 апреля 2020, принята к печати 1 октября 2020
Опубликована онлайн 5 ноября 2020
Список литературы
- Scales CD, Smith AC, Hanley JM, Saigal CS. Prevalence of kidney stones in the United States. Eur Urol. 2012;62(1):160–5.
- Fink HA, Wilt TJ, Eidman KE, Garimella PS, MacDonald R, Rutks IR, Brasure M, Kane RL, Ouellette J, Monga M. Medical management to prevent recurrent nephrolithiasis in adults: a systematic review for an American College of Physicians Clinical Guideline. Ann Intern Med. 2013;158(7):535.
- Khan SR, Pearle MS, Robertson WG, Gambaro G, Canales BK, Doizi S, Traxer O, Tiselius H. Kidney stones. Nat Rev Dis Primers. 2016;2(1):1–50.
- Taylor EN. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol. 2004;15(12): 3225–32.
- Ticinesi A, Milani C, Guerra A, Allegri F, Lauretani F, Nouvenne A, Mancabelli L, Lugli GA, Turroni F, Duranti S, et al. Understanding the gut–kidney axis in nephrolithiasis: an analysis of the gut microbiota composition and functionality of stone formers. GUT. 2018;67(12):2097–106.
- Stern JM, Moazami S, Qiu Y, Kurland I, Chen Z, Agalliu I, Burk R, Davies KP. Evidence for a distinct gut microbiome in kidney stone formers compared to non-stone formers. Urolithiasis. 2016;44(5):399–407.
- Tang R, Jiang Y, Tan A, Ye J, Xian X, Xie Y, Wang Q, Yao Z, Mo Z. 16S rRNA gene sequencing reveals altered composition of gut microbiota in individuals with kidney stones. Urolithiasis. 2018;46(6):503–14.
- Wolfe AJ, Brubaker L. “Sterile urine” and the presence of bacteria. Eur Urol. 2015;68(2):173–4.
- Karstens L, Asquith M, Caruso V, Rosenbaum JT, Fair DA, Braun J, Gregory WT, Nardos R, McWeeney SK. Community profiling of the urinary microbiota: considerations for low-biomass samples. Nat Rev Urol. 2018; 15(12):735–49.
- Gottschick C, Deng Z, Vital M, Masur C, Abels C, Pieper DH, Wagner-Döbler I. The urinary microbiota of men and women and its changes in women during bacterial vaginosis and antibiotic treatment. Microbiome. 2017;5(1): 15–99.
- Pearce MM, Hilt EE, Rosenfeld AB, Zilliox MJ, Thomas-White K, Fok C, Kliethermes S, Schreckenberger PC, Brubaker L, Gai X, et al. The female urinary microbiome: a comparison of women with and without urgency urinary incontinence. MBIO. 2014;5(4):e1214–83.
- Shrestha E, White JR, Yu S, Kulac I, Ertunc O, De Marzo AM, Yegnasubramanian S, Mangold LA, Partin AW, Sfanos KS. Profiling the urinary microbiome in men with positive versus negative biopsies for prostate cancer. J Urol. 2018;199(1):161–71.
- Dornbier RA, Bajic P, Van Kuiken M, Jardaneh A, Lin H, Gao X, Knudsen B, Dong Q, Wolfe AJ, Schwaderer AL. The microbiome of calcium-based urinary stones. Urolithiasis. 2019; [Epub ahead of print].
- Gosiewski T, Ludwig-Galezowska AH, Huminska K, Sroka-Oleksiak A, Radkowski P, Salamon D, Wojciechowicz J, Kus-Slowinska M, Bulanda M, Wolkow PP. Comprehensive detection and identification of bacterial DNA in the blood of patients with sepsis and healthy volunteers using next-generation sequencing method - the observation of DNAemia. Eur J Clin Microbiol Infect Dis. 2017;36(2):329–36.
- Païssé S, Valle C, Servant F, Courtney M, Burcelin R, Amar J, Lelouvier B. Comprehensive description of blood microbiome from healthy donors assessed by 16S targeted metagenomic sequencing. Transfusion. 2016;56(5): 1138–47.
- Shah NB, Allegretti AS, Nigwekar SU, Kalim S, Zhao S, Lelouvier B, Servant F, Serena G, Thadhani RI, Raj DS, et al. Blood microbiome profile in CKD: a pilot study. Clin J Am Soc Nephrol. 2019;14(5):692–701.
- Thorleifsson G, Holm H, Edvardsson V, Walters GB, Styrkarsdottir U, Gudbjartsson DF, Sulem P, Halldorsson BV, de Vegt F, D'Ancona FC, et al. Sequence variants in the CLDN14 gene associate with kidney stones and bone mineral density. Nat Genet. 2009;41(8):926–30.
- Foley KF, Boccuzzi L. Urine calcium: laboratory measurement and clinical utility. Lab Med. 2010;41(11):683–6.
- Curhan GC, Taylor EN. 24-h uric acid excretion and the risk of kidney stones. Kidney Int. 2008;73(4):489–96.
- Laube N, Pullmann M, Hergarten S, Schmidt M, Hesse A. The alteration of urine composition due to stone material present in the urinary tract. Eur Urol. 2003;44(5):595–9.
- Liu F, Zhang N, Jiang P, Zhai Q, Li C, Yu D, Wu Y, Zhang Y, Lv L, Xu X, et al. Characteristics of the urinary microbiome in kidney stone patients with hypertension. J Transl Med. 2020;18(1).
- Thomas-White K, Forster SC, Kumar N, Van Kuiken M, Putonti C, Stares MD, Hilt EE, Price TK, Wolfe AJ, Lawley TD. Culturing of female bladder bacteria reveals an interconnected urogenital microbiota. Nat Commun. 2018;9(1): 1557.
- Hilt EE, McKinley K, Pearce MM, Rosenfeld AB, Zilliox MJ, Mueller ER, Brubaker L, Gai X, Wolfe AJ, Schreckenberger PC. Urine is not sterile: use of enhanced urine culture techniques to detect resident bacterial flora in the adult female bladder. J Clin Microbiol. 2014;52(3):871–6.
- Price TK, Hilt EE, Thomas White K, Mueller ER, Wolfe AJ, Brubaker L. The urobiome of continent adult women: a cross‐sectional study. BJOG. 2019; [Epub ahead of print].
- Thomas-White KJ, Kliethermes S, Rickey L, Lukacz ES, Richter HE, Moalli P, Zimmern P, Norton P, Kusek JW, Wolfe AJ, et al. Evaluation of the urinary microbiota of women with uncomplicated stress urinary incontinence. Am J Obstet Gynecol. 2017;216(1):51–5.
- Kowarsky M, Camunas-Soler J, Kertesz M, De Vlaminck I, Koh W, Pan W, Martin L, Neff NF, Okamoto J, Wong RJ, et al. Numerous uncharacterized and highly divergent microbes which colonize humans are revealed by circulating cell-free DNA. Proc Natl Acad Sci U S A. 2017;114(36):9623–8.
- You YA, Yoo JY, Kwon EJ, Kim YJ. Blood microbial communities during pregnancy are associated with preterm birth. Front Microbiol. 2019;10:1122.
- Xie J, Huang JS, Huang XJ, Peng JM, Yu Z, Yuan YQ, Xiao KF, Guo JN. Profiling the urinary microbiome in men with calcium-based kidney stones. BMC Microbiol. 2020;20(1):41.
- Chen J, Zhao J, Cao Y, Zhang G, Chen Y, Zhong J, Huang W, Zeng J, Wu P. Relationship between alterations of urinary microbiota and cultured negative lower urinary tract symptoms in female type 2 diabetes patients. BMC Urol. 2019;19(1):13–78.
- Colas L, Mongodin EF, Montassier E, Chesneau M, Guerif P, Hittle L, Giral M, Bromberg JS, Brouard S. Unique and specific Proteobacteria diversity in urinary microbiota of tolerant kidney transplanted recipients. Am J Transplant. 2020;20(1):145–58.
- Soriano F, Ponte C, Santamaria M, Castilla C, Fernandez RR. In vitro and in vivo study of stone formation by Corynebacterium group D2 (Corynebacterium urealyticum). J Clin Microbiol. 1986;23(4):691–4.
- Soriano F, Ponte C, Santamaria M, Aguado JM, Wilhelmi I, Vela R, Delatte LC. Corynebacterium group D2 as a cause of alkaline-encrusted cystitis: report of four cases and characterization of the organisms. J Clin Microbiol. 1985; 21(5):788–92.
- Madani A, Kermani N, Ataei N, Esfahani S, Hajizadeh N, Khazaeipour Z, Rafiei
- Kwak C, Jeong BC, Ku JH, Kim HH, Lee JJ, Huh CS, Baek YJ, Lee SE. Prevention of nephrolithiasis by Lactobacillus in stone-forming rats: a preliminary study. Urol Res. 2006;34(4):265–70.
- Stanislawski M, Dabelea D, Lange L, Wagner B, Lozupone C. Gut microbiota phenotypes of obesity. NPJ Biofilms Microbiomes. 2019;5:18.
- Khasriya R, Sathiananthamoorthy S, Ismail S, Kelsey M, Wilson M, Rohn JL, Malone-Lee J. Spectrum of bacterial colonization associated with urothelial cells from patients with chronic lower urinary tract symptoms. J Clin Microbiol. 2013;51(7):2054–62.
- Gomez-Arango LF, Barrett HL, McIntyre HD, Callaway LK, Morrison M, Nitert MD. Contributions of the maternal oral and gut microbiome to placental microbial colonization in overweight and obese pregnant women. Sci Rep. 2017;7(1):2860.
- Koren O, Spor A, Felin J, Fak F, Stombaugh J, Tremaroli V, Behre CJ, Knight R, Fagerberg B, Ley RE, et al. Human oral, gut, and plaque microbiota in
- Price TK, Dune T, Hilt EE, Thomas-White KJ, Kliethermes S, Brincat C, Brubaker L, Wolfe AJ, Mueller ER, Schreckenberger PC. The clinical urine culture: enhanced techniques improve detection of clinically relevant microorganisms. J Clin Microbiol. 2016;54(5):1216–22.
- Mulet M, Lalucat J, Garcia-Valdes E. DNA sequence-based analysis of the Pseudomonas species. Environ Microbiol. 2010;12(6):1513–30.
- Jung CE, Chopyk J, Shin JH, Lukacz ES, Brubaker L, Schwanemann LK, Knight R, Wolfe AJ, Pride DT. Benchmarking urine storage and collection conditions for evaluating the female urinary microbiome. Sci Rep. 2019;9(1).
- Karstens L, Asquith M, Davin S, Stauffer P, Fair D, Gregory WT, Rosenbaum JT, McWeeney SK, Nardos R. Does the urinary microbiome play a role in urgency urinary incontinence and its severity? Front Cell Infect Microbiol. 2016;6:78.
- Davis NM, Proctor DM, Holmes SP, Relman DA, Callahan BJ. Simple statistical identification and removal of contaminant sequences in marker-gene and metagenomics data. Microbiome. 2018;6(1):226.
- Karstens L, Asquith M, Davin S, Fair D, Gregory WT, Wolfe AJ, Braun J, McWeeney S. Controlling for contaminants in low-biomass 16S rRNA gene sequencing experiments. mSystems. 2019;4(4):e219–90.
- Emily B, John P, Terry J. Bioinformation and ‘omic approaches for characterization of environmental microorganisms. In: Environmental microbiology. 3rd ed. Salt Lake City: Academic Press; 2015. p. 483–505.
- Kim B, Shin J, Guevarra RB, Lee JH, Kim DW, Seol K, Lee J, Kim HB, Isaacson RE. Deciphering diversity indices for a better understanding of microbial communities. J Microbiol Biotechn. 2017;27(12):2089–93.
- Goodrich JK, Di Rienzi SC, Poole AC, Koren O, Walters WA, Caporaso JG, Knight R, Ley RE. Conducting a microbiome study. CELL. 2014;158(2):250–62.
- Livanos AE, Greiner TU, Vangay P, Pathmasiri W, Stewart D, McRitchie S, Li H, Chung J, Sohn J, Kim S, et al. Antibiotic-mediated gut microbiome perturbation accelerates development of type 1 diabetes in mice. Nat Microbiol. 2016;1(11).
