Пол Р. Домингес-Гутьеррес, Элизабет П. Квенда, Саид Р. Хан и Бенджамин К. Каналес
Цель обзора
Новые данные свидетельствуют о том, что помимо малого объема мочи или гиперкальциурии, к факторам риска мочекаменной болезни также относится оксалат кальция (CaOx), один из наиболее распространенных минеральных компонентов мочи, вызывающий сильную иммунологическую реакцию. Данный обзор посвящен исследованиям и проектам, освещающим то, как в дальнейшем может развиваться терапия, направленная на профилактику мочекаменной болезни.
Последние исследования
За последние 2 года реакцию иммунной системы на кристаллы CaOx исследовали несколько групп ученых. Исследования проводились с использованием клеточной культуры и физиологических моделей животных. Домингес и соавт. обнаружили, что кристаллы CaOx распознаются моноцитами по липополисахарид-опосредованному механизму, что приводит к M1 фенотипу «воспалительного» макрофага. Патель и соавт. предполагают, что избыточные оксалат-опосредованные активные формы кислорода в митохондриях макрофагов могут нарушать их способность правильно очищать организм от камней. Две другие группы ученых работали с экспериментальными моделями мышей (поражение андрогенных рецепторов и сверхэкспрессия белка Sirtuin 3). Они выявили увеличение дифференциирования почечных противовоспалительных макрофагов и снижение отложения CaOx в экспериментальной группе в сравнении с контрольной. Андерс и соавт. кормили гипероксалурических мышей 1,3-бутандиолом, который блокирует воспалительную форму некроза клеток. Такая форма называется NLRP3-воспалением; вследствие эксперимента внутрипочечное окислительное повреждение уменьшилось, а противовоспалительные почечные инфильтраты выросли. Наконец, у моноцитов, подвергшиеся воздействию кристаллов CaOx, а затем гидроксиапатита, снизилась выработка воспалительных цитокинов и хемокинов по сравнению с моноцитами, не содержащими гидроксиапатит. Это позволяет предположить, что бляшка Рэндалла влияет на ослабление воспаления, вызванного M1 в ответ на CaOx,.
Аннотация
Модулируя иммунную реакцию, иммунотерапия способна предотвращать рецидивы мочекаменной болезни у некоторых людей. Замещение макрофагов M1 макрофагами M2 и ингибирование воспаления могут предотвратить соединение, которое приводит к нуклеации CaOx. В будущем, методы лечения могут быть направлены на разрушение кристаллов CaOx макрофагами для предотвращения образования камней.
Ключевые слова
Рецептор андрогена, оксалат кальция, воспаление, макрофаги, мочекаменная болезнь, бляшка Рэндалла, Сиртуин 3
ВВЕДЕНИЕ
Мочекаменная болезнь – весьма распространенное заболевание, оно связано с потенциальными осложнениями и создает финансовое бремя для обоих полов во всех возрастных группах. Распространенность симптоматической мочекаменной болезни в Соединенных Штатах составляет 8,8%, это примерно соответствует распространенности некоторым заболеваний, таких как диабет (9,4%), и превосходит ряд других, среди которых, такие болезни как хроническое обструктивное заболевание легких (6,3%) или инсульт (3%) [1,2]. В 2006 году расходы на лечение почечных камней в одних только Соединенных Штатах превысили 10 миллиардов долларов. Если учесть частоту рецидивов камней из оксалата кальция (CaOx), самого часто встречающегося минерального компонента камней, до 50% в течение первых 5 лет после первого выявления такого камня, неудивительно, что профилактика мочекаменной болезни является главным приоритетом для национальных институтов здравоохранения [3]. С другой стороны, даже самый расположенный к лечению пациент с почечными камнями, который использует стандартные диетические и фармакологические методы лечения, такие как гидратационная терапия, тиазидные диуретики и/или калия цитрат, может рассчитывать лишь на скромное снижение рецидивов в 50% [4]. Следовательно, есть острая необходимость в новых профилактических методах лечения, которые уменьшат бремя рецидивов почечных камней в Соединенных Штатах.
Общий анализ генома почечной ткани на модели нефролитиаза CaOx у грызунов показал повышенную выраженность генов, связанных с путями воспаления, иммунитета и активации комплемента [5].
Кафедра урологии, Университет Флориды, Гейнсвилл, Флорида, США
Корреспондирующий автор: Пол Р. Домингес-Гутьерресом, доктор медицинских наук, факультет урологии, Университет Флориды, 1600 СВ Арчер роуд, а/я 100247, Гейнсвиль, Фл. 32610-0247, США. Тел: +1 352 273 8236;
факс: +1 352 273 7515; Электронная почта: paul.dominguez@urology.ufl.edu Curr Opin Urol 2020, 30: 000–000 DOI: 10.1097 / MOU.0000000000000729
КЛЮЧЕВЫЕ МОМЕНТЫ
Камни из CaOx образуются и рецидивируют из-за почечных воспалительных стимуляторов.
- Воспалительные (М1) макрофаги - важный фактор образования камней из CaOx.
- Противовоспалительные заживляющие (М2) макрофаги предотвращают воспалительное повреждение CaOx.
- Успешные методы лечения могут зависеть от поляризации иммунологической реакции почек от воспалительных М1 до противовоспалительных макрофагов М2.
Дальнейшие исследования in vivo и in-vitro показали, что макрофаги M1 и M2 играют противоположные роли в развитии мочекаменной болезни. Гены, связанные с M1 ассоциируются с условиями, способствующими образованию камня, в то время как экспрессия генов, связанных с M2, наоборот, подавляет процесс образования камня. Подобное увеличение связанных с воспалением метаболических путей наблюдалось при исследованиях выражения генов в папиллярных тканях почек человека с бляшками Рэндалла или без них [6]. В 2016 году обнаружено, что «противовоспалительные» макрофаги человека M2 обладают способностью фагоцитировать и разрушать фрагменты почечных камней CaOx в течение 72 часов по клатрин-зависимому механизму [7]. Это открытие представляет интерес к потенциалу «иммунной» терапии для лечения мочекаменной болезни. За последние 2 года ряд групп ученных исследовали реакцию иммунной системы на кристаллы CaOx, используя модели на животных или клеточную культуру (таблица 1). В этом обзоре мы подробно рассмотрим данные публикации по CaOx и в заключении представим первичные данные, оценивающие роль иммунной системы в отношении образования бляшек Рэндалла.
ОКСАЛАТ КАЛЬЦИЯ СПОСОБСТВУЕТ ВОСПАЛИТЕЛЬНОМУ ОТВЕТУ В МОНОЦИТАХ И ВОСПАЛИТЕЛЬНЫХ МАКРОФАГАХ
В 2018 году Домингес и соавт. подвергали моноциты человека воздействию кристаллов CaOx или кристаллов гидроксиапатита, минерала, обнаруженного в бляшке Рэндалла. Моноциты реагировали только на CaOx, а не на гидроксиапатит, с воспалительными цитокинами/хемокинами в зависимости от дозы. Затем исследователи обнаружили, что супернатанты из этих моноцитов усиливали «заживление» М2, противовоспалительную миграцию макрофагов и кристаллический фагоцитоз. Кроме того, длительное воздействие CaOx на моноциты в течение 6 дней отличало их от «воспалительных» макрофагов M1. И наоборот, ни оксалат калия, ни оксалат цинка не влияли на дифференцирование, что позволяет предположить, что моноциты специфически распознавали кристаллы CaOx. Комбинирование этих результатов показывает, что CaOx-поляризованные моноциты активируют набор как воспалительных, так и противовоспалительных макрофагов в фагоцитирующие кристаллы CaOx. При длительном воздействии моноциты подталкиваются к воспалительному пути, возможно, чтобы избежать чрезмерного осаждения CaOx в ткани
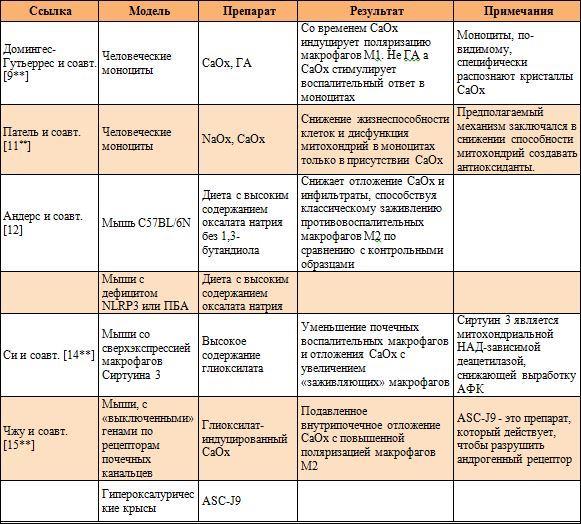

Таблица 1. Публикации, посвященные изучению взаимосвязи между иммунологической реакцией и кристаллами оксалата кальция с использованием моделей животных или клеточной культуры
ASC, белок, ассоциированный с апоптозом; CaOx, оксалат кальция; ГА, гидроксиапатит; НАД, никотинамид-адениндинуклеотид; АФК, активные формы кислорода.
МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ, СВЯЗАННАЯ С ОКСАЛАТОМ
CaOx – самый распространенный минеральный компонент почечных камней [8]. Прежде чем попасть в почку для фильтрации и выведения из организма, оксалат поступает В кровь как из пищевых продуктов (зелень, витамин С, коллаген), так и из метаболических источников (синтез в печени). Кристаллическая форма оксалата (CaOx) образуется в почке, когда при небольшом объеме в моче присутствуют избыточные кальций и оксалат, а очистка от этих отложений опосредуется первичными моноцитами, дифференцирующимися в макрофаги М2 [9&&]. Как мы уже обсуждали ранее, диспропорциональные количества CaOx могут индуцировать цитокин-опосредованный набор количества воспалительных клеток и генерацию активных форм кислорода (АФК) [10]. Патель и соавт. [11&&] в 2018 г. предположили, что, возможно, иммунная дисфункция при мочекаменной болезни включает чрезмерное опосредованное оксалатами образование АФК в митохондриях, нарушая процесс очистки от камней через АФК-опосредованное повреждение митохондрий моноцитов.
Чтобы поддержать эту теорию, они протестировали влияние различных концентраций NaOx (растворимых) и CaOx (нерастворимых) на человеческие моноциты. Когда моноциты подвергались воздействию возрастающих доз нерастворимого CaOx, жизнеспособность клеток снижалась в зависимости от дозы. Митохондрии также были подвержены влиянию снижения базального уровня потребления кислорода (УПК) и OTP-связанного УПК. Хотя аналогичные результаты УПК были отмечены в клетках, подвергнутых воздействию NaOx, авторы отметили, что жизнеспособность клеток не была затронута. Чтобы определить причины этого несоответствия, они изучили различия в уровнях генов и белков между группами. Ученые обнаружили, что у моноцитов, подвергшихся воздействию CaOx, наблюдалось дозозависимое снижение выраженности супероксиддисмутазы марганца (митохондриальный антиоксидант) – это обнаружилось только при очень высокой (> 2 ммоль/л) концентрации NaOx [11&&]. Эти данные свидетельствуют о том, что повышение уровня оксалатов может влиять на митохондриальную функцию циркулирующих первичных моноцитов, возможно, приводя к измененной поляризации макрофагов через движение M1 над макрофагами M2 в местах воспаления и повреждения в почках [9&&]. Такое предпочтение M1 может привести к повреждению клеток и может объяснить высокую частоту рецидивов мочекаменной болезни у пациентов с гипероксалурией.
ОКСАЛАТ КАЛЬЦИЯ И ПОПОЛНЕНИЕ NLRP3 ВОСПАЛИТЕЛЬНЫХ МАКРОФАГОВ
Не все повреждения CaOx опосредованы через АФС. Андерс и соавт. предположили, что воспаление и повреждение могут также быть вызваны CaOx через воспалительную систему NLPR3, которая взаимодействует с белком, ассоциированный с апоптозом (БАА), чтобы инициировать опосредованную воспалением гибель клеток, вызывая высвобождение провоспалительных цитокинов IL-1β и IL-18 [12]. У мышей с дефицитом NLRP3 или ПБА (ASC), которых держали на диете с высоким содержанием оксалатов, наблюдалось значительно меньшее интраренальное содержание CaOx, уровень повреждения канальцев и повреждение молекулы почки-1 (KIM-1) по сравнению с дикими мышами. Аналогичным образом, мыши, которых кормили продуктами с высоким содержанием оксалатов на 1,3-бутандиоле (ингибиторе NLRP3) продемонстрировали сходное интраренальное отложение CaOx и выработку IL-1b, но заметно сниженные уровни креатинина и KIM-1 в плазме, показатели повреждения канальцев и фиброз почек, по сравнению с мышами из контрольной группы, на которых никак не воздействовали. Наконец, у мышей, которых кормили 1,3-бутандиолом, были почечные инфильтраты, которые заживали классически, под контролем противовоспалительных макрофагов M2c по сравнению с контрольной группой, в которой были обнаружены провоспалительные M1 и профибротические M2a-подобные макрофаги. В целом, эти результаты показывают, что блокирование NLRP3 может предотвратить оксалатное повреждение путем изменения инфильтратии макрофагов.
СИРТУИН 3 СПОСОБСТВУЕТ РОСТУ ПРОТИВОВОСПАЛИТЕЛЬНЫХ МАКРОФАГОВ И ОЧИЩЕНИЮ ОТ ОКСАЛАТА КАЛЬЦИЯ
Сиртуин 3 (SIRT3) является митохондриальной никотинамид-адениндинуклеотид (НАД)-зависимой деацетилазой, которая функционирует в митохондриях, усиливая дыхание и снижая выработку АФК [13]. Следовательно, SIRT3 играет потенциальную роль при наличие камней и является терапевтической мишенью [14&&]. По сравнению с контрольной группой, Кси и соавторы обнаружили, что интактные макрофаги, происходящие из костного мозга, подвергшиеся воздействию CaOx, снижали выраженность SIRT3 и увеличивали провоспалительные медиаторы, такие как вовлеченный в иммунные реакции белок O1 (FOXO1-AC), TNFa, IL-1β и IL-6.
Кроме того, после созревания во взрослых воспалительных макрофагах эти клетки продолжали отправлять воспалительные сигналы (оксид азотная адаптация, TNFa, FOXO1-Ac) и снижали количество SIRT3. Затем, используя лентивирусную генную терапию на мышиной модели, сверхэкспрессировали макрофаги SIRT3 и сравнивали почечные изменения при кормлении пищей с высоким содержанием глиоксалата. Несмотря на отсутствие различий в выработке циркулирующих воспалительных цитокинов, мыши, которые очень сильно выражали SIRT3, имели меньше почечных воспалительных макрофагов и внутрипочечных отложений кристаллов CaOx и больше противовоспалительных макрофагов, чем в контрольной группе. В целом, эти результаты показывают, что повышение SIRT3 может предотвратить повреждение, вызванное оксалатами, путем изменения инфильтрации макрофагов.
РЕЦЕПТОР АНДРОГЕНА СПОСОБСТВУЕТ ВОСПАЛИТЕЛЬНЫМ ПРОЦЕССАМ ПРИ МОЧЕКАМЕННОЙ БОЛЕЗНИ
Хотя распространенность камней в почках растет среди женщин, это заболевание чаще встречается у мужчин, и предшествующие исследования предполагают связь между мочекаменной болезнью и рецептором андрогенов (РА). Чтобы определить влияние РА и на дифференцировку макрофагов, Чжу и соавт. [15&&] использовали миграцию интактных макрофагов в верхних отделах и проксимальных канальцах (HK-2, HKC-8), размещенными в нижней. Когда клетки канальцев подвергали воздействию CaOx, они набирали макрофаги из верхних отделов и дифференцировали их как воспалительные макрофаги. Однако, когда небольшая интерферирующая РНК использовалась для выключения гена РА в проксимальных канальцевых клетках, макрофаги дифференцировались как противовоспалительные макрофаги. Чжу и соавт. определили молекулярный и регуляторный механизм, с помощью которого РА поляризовали макрофаги: РА косвенно регулирует CSF-1 (фактор, стимулирующий колонию макрофагов), цитокин, который поляризует моноциты и интактные макрофаги в противовоспалительные макрофаги – через микроРНК (miR- ) 185-5p. Когда РА активируется, он активирует miR-185-5p. В свою очередь, miR-185-5p нацеливается на мРНК CSF-1 для расщепления, что приводит к снижению CSF-1. С потерей CSF-1 противовоспалительные макрофаги не могут развиваться, что приводит к увеличению числа воспалительных макрофагов. Затем Чжу продемонстрировал терапевтическое доказательство этой концепции, используя препарат (ASC-J9), который специфически разлагает РА. Когда у крыс, получавших ASC-J9, был повышенный уровень содержания диоксалурата в рационе питания, у них наблюдалось уменьшение количества внутрипочечных кристаллов CaOx, увеличение производства M-CSF и поляризация макрофагов M2. Однако, когда крысам вводили Agomir-185-5p (miR-185-5p mimic), эффекты ASC-J9 шли в обратном направлении. Взятые вместе, эти результаты показывают, что РА играет важную роль в патогенезе камней и может стать терапевтической мишенью в будущем.
БУДУЩИЕ НАПРАВЛЕНИЯ ИММУНОТЕРАПИИ: БЛЯШКИ РЭНДАЛЛА
Бляшки Рэндалла представляют собой кальцификации, которые появляются в почечной сосочковой интерстициальной ткани и тесно связаны с формированиtv первичных оксалатных камней [16]. Когда эта бляшка подвергается воздействию мочи, она действует как матрица для нуклеации CaOx, что приводит к образованию камней непосредственно на поверхности сосочка [17]. Бляшки Рэндалла состоят из фосфата кальция в форме гидроксиапатита, который агрегирует и кальцинирует окружающую коллагеновую ткань и мембранные везикулы [16, 18–20]. Из-за связи между воспалением и кальцификацией во многих других участках тела, одна из ведущих теорий патогенезиса камней утверждает, что бляшки Рэндалла могут происходить из-за воспаления. Повторные циклы гипероксалурии или отхождения камня могут привести к повторным циклам папиллярного повреждения и воспаления, что приводит к кальцификации как меры защиты [21,22].
Хан и соавт. показали, что почечные эпителиальные клетки гипероксалурических крыс дифференцируются как остеобластоподобные клетки, которые продуцируют минерализующиеся молекулы. Этот процесс напоминает ранние стадии образования атеросклеротических бляшек [23]. Внурти атером воспалительные макрофаги способствуют микрокальцификации через везикулярную минерализацию и дифференцировки гладкомышечных клеток сосудов (ГМКС) в остеобласты. Обратное также верно – противовоспалительные макрофаги способствуют регрессии атеросклеротической бляшки [24,25]. Поэтому есть большая надежда, что прогрессирование бляшек Рэндалла, как и развитие атеросклеротической бляшки, может быть остановлено или даже обращено вспять с помощью соответствующих противовоспалительных подходов.
Чтобы проверить эту идею, наша группа подвергла человеческие моноциты воздействию гидроксиапатита в течение 6 дней. В отличие от возмдействия CaOx, описанного ранее [9], моноциты дифференцировались как М2 (противовоспалительные) макрофаги, а не М1 (рис. 1). Кроме того, когда на собственные моноциты воздействовал CaOx, а затем через час кристаллы гидроксиапатита, в группе CaOx/гидроксиапатит отмечено значительное снижение выработки воспалительных цитокинов и хемокинов, чем в группе только CaOx, причем, настолько выраженное, что это выглядело так же, как у контрольной группы (отрицательный PBS) (рис. 2). Эти данные предполагают, что бляшки Рэндалла могут «ослаблять» воспалительную реакцию CaOx M1, одновременно способствуя заживлению и очистке через путь M2. Поскольку цикл повторяется, металлопротеиназы и гиалурондазы разлагают сосочки, приводя к литогенному воздействию мочи и возможному образованию камней из бляшек Рэндалла.

РИСУНОК 1. Гидроксиапатит заставляет моноциты дифференцироваться как противовоспалительные (М2) макрофаги. Гидроксиапатитовые макрофаги были положительными в отношении маркеров противовоспалительного CD163 и фосфорилированного STAT6, но отрицательными в отношении маркеров воспалительных макрофагов CD68 и CD206.
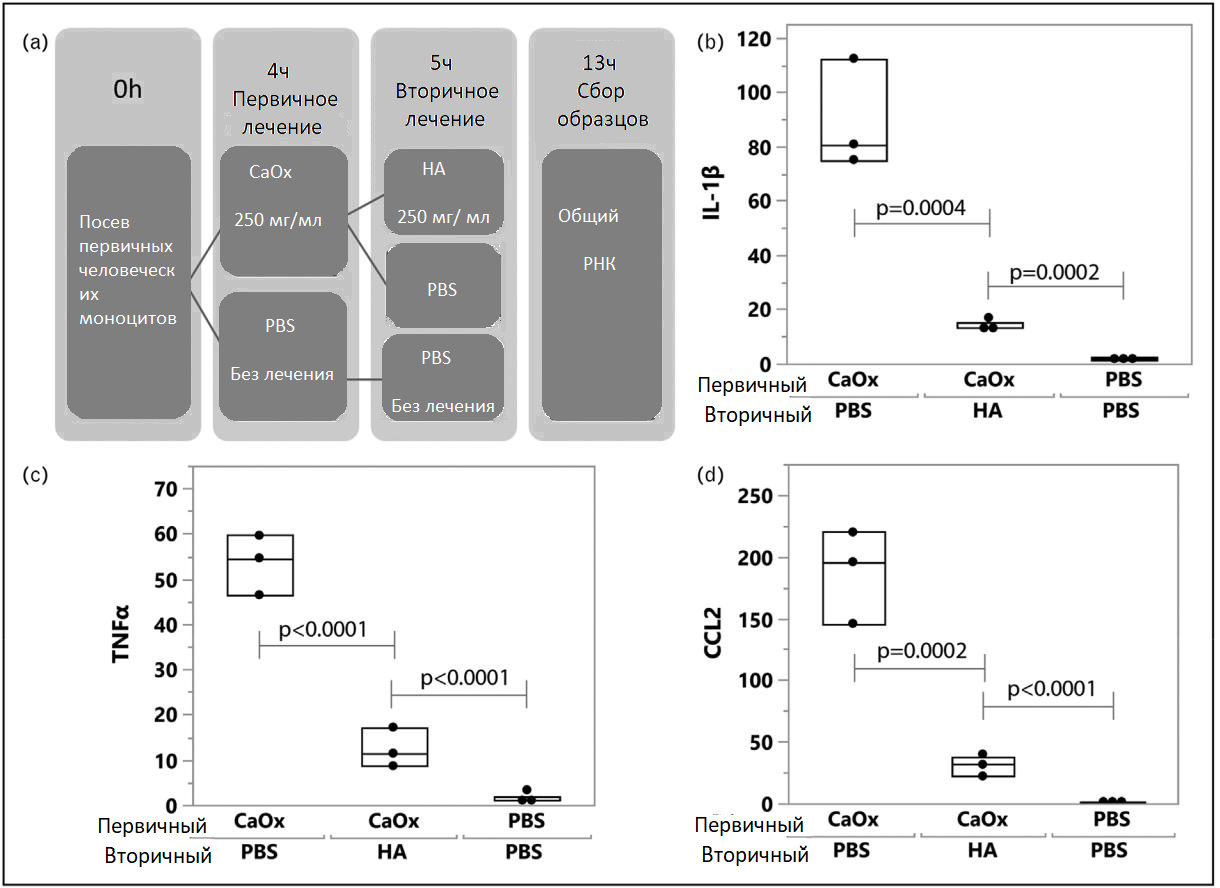
РИСУНОК 2. Гидроксиапатит ингибирует воспаление оксалата кальция в первичных моноцитах. (а) Схема обработки для гидроксиапатита и оксалата кальция. (b–d) Оксалат кальция, за которым следует PBS (оксалат кальция/PBS), вызывает значительное увеличение содержания IL-1β, TNFa и CC-хемокина 2 (также известного как моноцитарный хемоаттрактантный белок-1) по сравнению с оксалатом кальция, за которым следует гидроксиапатит (оксалат кальция/гидроксиапатит) и (PBS/PBS) без лечения. Значительных различий между оксалатом/гидроксиапатитом кальция и PBS/PBS не отмечено. Эксперимент представляет анализ в трех экземплярах. Значения P определены с помощью теста Даннетта в сравнении с контрольным образцом.
Эволюционно говоря, создание инертного минерального отложения (например, гидроксиапатита) и образование бляшек Рэндалла предпочтительнее постоянного воспаления, которое потенциально может привести к почечной дисфункции. Кроме того, блокирование остеогенного дифференцирования может ингибировать рост бляшек при одновременном усилении минеральной резорбции через дифференцирование макрофагов в остеокластоподобные клетки – возможно, это даже приведет к регрессии [26]. Наша группа [16,27], а также другие ученые [34] предположили, что образование бляшек Рэндалла и образование камней сходно с кальцификацией сосудов в почках, которая начинается с того, что ГМКС приобретают остеогенный фенотип [22,28,29]. Эта гипотеза основана на ряде клинических и экспериментальных наблюдений, таких как сочетание сердечно-сосудистых заболеваний (ССЗ) с нефролитиазом, выработка АФК и развитие воспаления как при кальцификации сосудов, так и при нефролитиазе CaOx, вовлечении одних и тех же макромолекул как в кристализацию мочи так и в кальцификацию сосудов, присутствие матричных везикул в местах кальцификации, а также наличие маркеров остеогенеза в почечных сосочках и моче при образовании камней. Эпидемиологические исследования показывают связь между образованием камней в почках и различными ССЗ [30,31]. Пациенты с такими распространенными заболеваниями, как гипертония [32], диабет [33] и метаболический синдром, подвержены риску образования камней, в то время как образование камней повышает риск гипертонии [35], хронических заболеваний почек и почечной недостаточности последней стадии [23,26,36]. CSF-1 активирует противовоспалительные макрофаги и остеокласты, способствуя остеолизису [37,38]. Как уже упоминалось ранее, противовоспалительные макрофаги являются основными факторами, которые предотвращают внутрипочечные отложения и очищение от оксалатов. Если бы CSF-1 мог быть локализован в почке, это могло бы облегчить удаление бляшки Рэндалла посредством остеолизиса и, возможно, даже предотвратить рецидив образования почечного камня.
ВЫВОД
Существуют убедительные доказательства, подтверждающие что иммунная система играет роль посредника в образовании камней из CaOx и патогенезе мочекаменной болезни. Важнейшую роль в процессе очищения от камней выполняют противовоспалительные макрофаги М2, которые способствуют фагоцитозу камней и помогают предотвратить повреждение почек. Таким образом, модулирование моноцитарной поляризации в местах воспаления и камнеобразования придает большое значение потенциально новой эре в лечении мочекаменной болезни. По мере нашего дальнейшего прогресса в понимании образования камней и иммунной биологии будущие исследования могут помочь выявить иммунотерапевтические мишени для лечения и профилактики почечных камней.
Конфликт интересов
B.K.C. получил грантовую поддержку через Alnylam Pharma-ceuticals и Национальные институты здравоохранения. Автору заплатили за его услуги в Комитете по рассмотрению контента AUA, и он имеет право собственности/опционы на акции в компаниях AP LifeSciences и ForTec Litho, LLC – ни один из которых не противоречит целям этого обзора. У остальных авторов нет конфликта интересов.
ПЕРЕЧЕНЬ ЛИТЕРАТУРЫ И РЕКОМЕНДОВАННЫЕ ИСТОЧНИКИ
Документы, представляющие особый интерес, опубликованные в течение годового периода обзора, были выделены как:
& – особый интерес
&& – невероятный интерес
1. Goldfarb DS. Increasing prevalence of kidney stones in the United States. Kidney Int 2003; 63:1951–1952.
2. Scales CD, Smith AC, Hanley JM, Saigal CS. Urologic diseases in America Project. Prevalence of kidney stones in the United States. Eur Urol 2012; 62:160–165.
3. Khan SR, Pearle MS, Robertson WG, et al. Kidney stones. Nat Rev Dis Primers 2016; 2:16008.
4. Fink HA, Wilt TJ, Eidman KE, et al. Medical management to prevent recurrent nephrolithiasis in adults: a systematic review for an American College of Physicians Clinical Guideline. Ann Intern Med 2013; 158:535–543.
5. Okada A, Yasui T, Hamamoto S, et al. Genome-wide analysis of genes related to kidney stone formation and elimination in the calcium oxalate nephrolithiasis model mouse: detection of stone-preventive factors and involvement of macrophage activity. J Bone Miner Res 2009; 24:908–924.
6. Taguchi K, Hamamoto S, Okada A, et al. Genome-wide gene expression profiling of Randall’s plaques in calcium oxalate stone formers. J Am Soc Nephrol 2017; 28:333–347.
7. Kusmartsev S, Dominguez-Gutierrez PR, Canales BK, et al. Calcium oxalate stone fragment and crystal phagocytosis by human macrophages. J Urol 2016; 195(4 Pt 1):1143–1151.
8. Finkielstein VA, Goldfarb DS. Strategies for preventing calcium oxalate stones. CMAJ 2006; 174:1407–1409.
9. && Dominguez-Gutierrez PR, Kusmartsev S, Canales BK, Khan SR. Calcium oxalate differentiates human monocytes into inflammatory M1 macrophages. Front Immunol 2018; 9:1863. In this study, the authors found that calcium oxalate (CaOx) crystals elicited a localized inflammatory response from human monocytes that aided in macrophage differentiation. The supernatants taken from these sites of inflammation promoted differentiation of M2 anti-inflammatory macrophage differentiation. However, prolonged CaOx exposure led to increased M1 inflammatory macrophages that promoted further CaOx crystal deposition.
10. Khan SR. Reactive oxygen species, inflammation and calcium oxalate nephrolithiasis. Transl Androl Urol 2014; 3:256–276.
11. && Patel M, Yarlagadda V, Adedoyin O, et al. Oxalate induces mitochondrial dysfunction and disrupts redox homeostasis in a human monocyte derived cell line. Redox Biol 2018; 15:207–215. The study elucidated the effects of oxalate on monocyte mitochondrial function. By exposing human monocytes to various concentrations of oxalate and measuring markers of mitochondrial function and redox homeostasis they exposed that oxalate impairs the mitochondrial function of monocytes in the peripheral blood. Their findings suggest that elevated oxalate levels in the peripheral blood impairs monocyte function and can subsequently impair macrophage function at sites of inflammation and within the kidney.
12. Anders HJ, Suarez-Alvarez B, Grigorescu M, et al. The macrophage phenotype and inflammasome component NLRP3 contributes to nephrocalcinosisrelated chronic kidney disease independent from IL-1-mediated tissue injury. Kidney Int 2018; 93:656–669.
13. Scher MB, Vaquero A, Reinberg D. SirT3 is a nuclear NADþ-dependent histone deacetylase that translocates to the mitochondria upon cellular stress. Genes Dev 2007; 21:920–928. Future of kidney stone management. Volume 30 Number 00 Month 2020 Copyright © 2020 Wolters Kluwer Health, Inc. Unauthorized reproduction of this article is prohibited. CE: Swati; MOU/300212; Total nos of Pages: 7; MOU 300212
14. && Xi J, Chen Y, Jing J, et al. Sirtuin 3 suppresses the formation of renal calcium oxalate crystals through promoting M2 polarization of macrophages. J Cell Physiol 2019; 234:11463–11473. The study showed how Sirtuin 3 works to suppress inflammation and apoptosis by promoting deacetylation of forkhead box O1. By overexpressing Sirtuin using gene therapy, the investigators were able to increase anti-inflammatory macrophages while simultaneously decreasing renal CaOx deposit in mice on a high oxalate diet.
15. && Zhu W, Zhao Z, Chou F, et al. Loss of the androgen receptor suppresses intrarenal calcium oxalate crystals deposition via altering macrophage recruitment/M2 polarization with change of the miR-185-5p/CSF-1 signals. Cell Death Dis 2019; 10:275. In-depth study investigating the role of the androgen receptor (AR) in CaOx crystal deposition. Using in-vivo rat models and AR knockout mice, the study showed that targeting the AR can potential influence the polarization of macrophages at sites of intrarenal CaOx deposition – leading to enhanced crystal clearance.
16. Khan SR, Canales BK. Unified theory on the pathogenesis of Randall’s plaques and plugs. Urolithiasis 2015; 43(Suppl 1):109–123.
17. Evan AP, Lingeman JE, Coe FL, et al. Randall’s plaque of patients with nephrolithiasis begins in basement membranes of thin loops of Henle. J Clin Invest 2003; 111:607–616.
18. Khan SR, Rodriguez DE, Gower LB, Monga M. Association of Randall plaque with collagen fibers and membrane vesicles. J Urol 2012; 187:1094–1100.
19. Khan SR. The role of Randall’s plaques in urolithiasis. Foreword. Urolithiasis 2015; 43(Suppl 1):1–3.
20. Joshi S, Clapp WL, Wang W, Khan SR. Osteogenic changes in kidneys of hyperoxaluric rats. Biochim Biophys Acta 2015; 1852:2000–2012.
21. Shroff RC, Shanahan CM. The vascular biology of calcification. Semin Dial 2007; 20:103–109.
22. Shanahan CM. Inflammation ushers in calcification: a cycle of damage and protection? Circulation 2007; 116:2782–2785.
23. Shioi A, Ikari Y. Plaque calcification during atherosclerosis progression and regression. J Atheroscler Thromb 2018; 25:294–303.
24. Potteaux S, Gautier EL, Hutchison SB, et al. Suppressed monocyte recruitment drives macrophage removal from atherosclerotic plaques of Apoe/ mice during disease regression. J Clin Invest 2011; 121:2025–2036.
25. Feig JE, Vengrenyuk Y, Reiser V, et al. Regression of atherosclerosis is characterized by broad changes in the plaque macrophage transcriptome. PLoS One 2012; 7:e39790.
26. Rogers MA, Aikawa M, Aikawa E. Macrophage heterogeneity complicates reversal of calcification in cardiovascular tissues. Circ Res 2017; 121:5–7.
27. Khan SR, Glenton PA, Backov R, Talham DR. Presence of lipids in urine, crystals and stones: implications for the formation of kidney stones. Kidney Int 2002; 62:2062–2072.
28. Gambaro G, D’Angelo A, Fabris A, et al. Crystals, Randall’s plaques and renal stones: do bone and atherosclerosis teach us something? J Nephrol 2004; 17:774–777.
29. Briet M, Burns KD. Chronic kidney disease and vascular remodelling: molecular mechanisms and clinical implications. Clin Sci 2012; 123:399–416.
30. Devarajan A. Cross-talk between renal lithogenesis and atherosclerosis: an unveiled link between kidney stone formation and cardiovascular diseases. Clin Sci 2018; 132:615–626.
31. Devarajan A. Anecdotes of lithogenesis and atherogenesis conversely liable for cardiac dysfunction and kidney stone formation. Urolithiasis 2015; 43:197.
32. Obligado SH, Goldfarb DS. The association of nephrolithiasis with hypertension and obesity: a review. Am J Hypertens 2008; 21:257–264.
33. Khan SR. Is oxidative stress, a link between nephrolithiasis and obesity, hypertension, diabetes, chronic kidney disease, metabolic syndrome? Urol Res 2012; 40:95–112.
34. West B, Luke A, Durazo-Arvizu RA, et al. Metabolic syndrome and selfreported history of kidney stones: the National Health and Nutrition Examination Survey (NHANES III). Am J Kidney Dis 2008; 51:741–747.
35. Shoag J, Halpern J, Goldfarb DS, Eisner BH. Risk of chronic and end stage kidney disease in patients with nephrolithiasis. J Urol 2014; 192:1440–1445.
36. Rule AD, Krambeck AE, Lieske JC. Chronic kidney disease in kidney stone formers. Clin J Am Soc Nephrol 2011; 6:2069–2075.
37. Mundy GR, Edwards CM, Edwards JR, et al. Localized osteolysis. Principles of bone biology. Amsterdam, The Netherlands: Elsevier; 2008; 1391–1413.
38. Lorenzo J. The effects of immune cell products (cytokines and hematopoietic cell growth factors) on bone cells. Osteoimmunology. Amsterdam, The Netherlands: Elsevier; 2011; 187–225.
